题目内容
【题目】乙酸乙酯是一种重要的化工原料,广泛用于药物染料、香料等工业。查阅资料得到下列数据:
物质 | 沸点/℃ | 密度/ | 相对分子质量 | 水溶性 |
乙醇 | 78.0 | 0.8 | 46 | 互溶 |
乙酸 | 118.0 | 1.1 | 60 | 可溶 |
乙酸乙酯 | 77.5 | 0.9 | 88 | 微溶 |
乙醚 | 34.6℃ | 0.7 | 74 | 微溶 |
浓硫酸(98%) | 338.0 | 1.8 | 98 | 易溶 |
无水氯化钙 | 可与乙醇形成难溶于水的CaCl2·6C2H5OH | |||
请回答以下问题:
(1)实验室常用下图装置来制备乙酸乙酯。
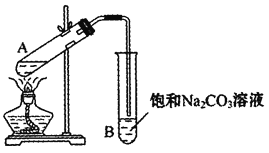
①配制反应混合液时,乙醇、冰醋酸和浓硫酸的混合顺序是________;浓硫酸对反应有催化作用,但加入的浓硫酸不能太多也不能太少,原因是________。
②防止加热时液体暴沸,需要在试管加入碎瓷片,如果加热一段时间后发现忘记了加碎瓷片,应该采取的正确操作是________。
A.立即补加 B.冷却后补加 C.不需补加 D.重新配料
③实验中饱和碳酸钠溶液的作用是________。
(2)产品纯化。分液法从试管B中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,首先向乙酸乙酯中加入无水氯化钙,除去________(填名称);然后再加入无水硫酸钠除去水,最后进行________(填操作名称),得到较纯净的乙酸乙酯。
(3)该实验中用30 g乙酸与46 g乙醇反应,如果实际得到的乙酸乙酯的质量是30.8 g,则该实验中乙酸乙酯的产率是________。(产率指的是某种生成物的实际产量与理论产量的比值)
(4)另一化学小组设计下图所示的装置制取乙酸乙酯(铁架台、铁夹、加热装置均已略去)。此装置和上图装置相比的优点是________(写出一条即可)。
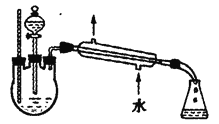
【答案】乙醇、浓硫酸、冰醋酸 浓硫酸能够吸收反应产生的水,使平衡正向移动,提高乙酸乙酯的产率;浓硫酸同时具有强氧化性和脱水性,会使有机物碳化,降低酯的产率,因此浓硫酸不能过少,也不能过多 B 溶解乙醇;反应消耗乙酸;降低乙酸乙酯的溶解度 乙醇 蒸馏 70.0% 能够控制反应温度,减少副反应的发生
【解析】
(1)①为防止酸液飞溅,应先加入乙醇,然后再加入浓硫酸和乙酸;根据浓硫酸的作用分析判断;
②从实验安全角度分析判断;
③根据加热时乙醇、乙酸易挥发,且乙酸乙酯的沸点比较低,结合物质的物理性质和化学性质及分离提纯的目的解答;
(2)根据无水氯化钙可与乙醇形成难溶于水的CaCl2·6C2H5OH分析;
(3)先计算乙酸、乙醇的物质的量,利用二者反应关系计算理论上乙酸乙酯的产量,最后根据产率的含义计算乙酸乙酯的产率;
(4)装置中使用了温度计,可控制反应温度,能够减少副反应的发生。
(1)①浓硫酸遇乙醇会放出大量热,由于乙醇的密度比硫酸小,为防止酸滴飞溅,应先加入乙醇,然后沿器壁缓缓加入浓硫酸,并用玻璃塞不断搅拌,使热量迅速扩散,当混合溶液冷却后再加入乙酸,如先加浓硫酸就会出现酸液飞溅现象,故加入物质的先后顺序是乙醇、浓硫酸、乙酸;在该反应中浓硫酸的作用是催化剂和吸水剂,由于该进行的比较缓慢,且反应是可逆反应,反应产生水,为了提高反应速率,同时提高乙酸乙酯的产率,要加入一定量的浓硫酸作催化剂,并在加热条件下进行;但由于浓硫酸同时具有强的氧化性和脱水性,若浓硫酸加入量过多,在加热时会将有机物脱水碳化,也不利用反应的发生,因此浓硫酸不能太多;
②为防止加热时液体暴沸,需要在试管加入碎瓷片,如果加热一段时间后发现忘记了加碎瓷片,应该采取的正确操作是冷却后补加,故合理选项是B;
③在实验中,反应产生的乙酸乙酯及挥发的乙醇和乙酸都通过导气管进入到盛有饱和碳酸钠溶液的试管中,饱和碳酸钠溶液的作用是溶解乙醇;反应消耗乙酸;降低乙酸乙酯的溶解度;
(2)分液法从试管B中分离出的乙酸乙酯中常含有一定量的乙醇、乙醚和水,首先向乙酸乙酯中加入无水氯化钙,无水氯化钙与乙醇反应产生CaCl2·6C2H5OH,可以达到除去其中含有的乙醇的目的;然后再加入无水硫酸钠除去水,最后进行根据乙酸乙酯与乙醚沸点的不同,采用蒸馏方法分离得到乙酸乙酯;
(3)30 g乙酸的物质的量是n(CH3COOH)=30 g÷60 g/mol=0.5 mol,46 g乙醇的物质的量n(C2H5OH)=46 g÷46 g/mol=1 mol,由于二者反应的物质的量的比是1:1,所以反应产生乙酸乙酯要根据不足量的乙酸计算,反应产生的乙酸乙酯的物质的量n(乙酸乙酯)=0.5 mol,其质量m(乙酸乙酯)=0.5 mol×88 g/mol=44 g,实际得到的乙酸乙酯的质量是30.8 g,则该实验中乙酸乙酯的产率是:![]() ×100%=70.0%;
×100%=70.0%;
(4)根据装置图可知:该装置中使用了温度计,可控制反应温度,能够减少副反应的发生,从而可提高物质的产率。

【题目】煤燃烧排放的烟气含有SO2和NOx,大量排放烟气形成酸雨、污染大气,因此对烟气进行脱硫、脱硝,对环境保护有重要意义。回答下列问题:
Ⅰ.利用CO脱硫
(1)工业生产可利用CO气体从燃煤烟气中脱硫,则25℃时CO从燃煤烟气中脱硫的热化学方程式2CO(g)+SO2(g)2CO2(g)+S(s)的焓变△H=_____________。25℃,100kPa时,由元素最稳定的单质生成1mol纯化合物时的反应热称为标准摩尔生成焓,已知一些物质的“标准摩尔生成焓”如下表所示:
物质 | CO(g) | CO2(g) | SO2(g) |
标准摩尔生成焓fHm(25℃)/kJmol-1 | -110.5 | -393.5 | -296.8 |
(2)在模拟脱硫的实验中,向多个相同的体积恒为2L的密闭容器中分别通入2.2mol CO和1mol SO2气体,在不同条件下进行反应,体系总压强随时间的变化如图所示。

①在实验b中,40 min达到平衡,则0~40 min用SO2表示的平均反应速率v(SO2)=_______。
②与实验a相比,实验b可能改变的条件为_______________,实验c可能改变的条件为_________________。
Ⅱ.利用NH3脱硝
(3)在一定条件下,用NH3消除NO污染的反应原理为:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H=-1807.98kJ·mol-1。在刚性容器中,NH3与NO的物质的量之比分别为X、Y、Z(其中X<Y<Z),在不同温度条件下,得到NO脱除率(即NO转化率)曲线如图所示。
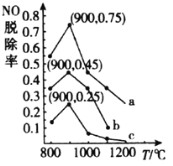
①NH3与NO的物质的量之比为X时对应的曲线为_____________(填“a”“b”或“c”)。
②各曲线中NO脱除率均先升高后降低的原因为__________。
③900℃条件下,设Z=![]() ,初始压强p0,则4NH3(g)+6NO(g)5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
,初始压强p0,则4NH3(g)+6NO(g)5N2(g)+6H2O(l)的平衡常数Kp=_____________(列出计算式即可)。
Ⅲ.利用NaCIO2脱硫脱硝
(4)利用NaClO2的碱性溶液可吸收SO2和NO2(物质的量之比为1:1)的混合气体,自身转化为NaCl,则反应的离子方程式为________________。