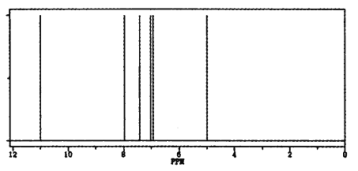
��Ŀ����
����Ŀ��úȼ���ŷŵ���������SO2��NOx�������ŷ������γ����ꡢ��Ⱦ��������˶��������������������Ի�����������Ҫ���塣�ش��������⣺
��.����CO����
(1)��ҵ����������CO�����ȼú������������25��ʱCO��ȼú������������Ȼ�ѧ����ʽ2CO(g)��SO2(g)2CO2(g)��S(s)���ʱ��H��_____________��25�棬100kPaʱ����Ԫ�����ȶ��ĵ�������1mol��������ʱ�ķ�Ӧ�ȳ�Ϊ��Ħ�������ʣ���֪һЩ���ʵ�����Ħ�������������±���ʾ��
���� | CO(g) | CO2(g) | SO2(g) |
��Ħ��������fHm(25��)/kJmol-1 | -110.5 | -393.5 | -296.8 |
(2)��ģ�������ʵ���У�������ͬ�������Ϊ2L���ܱ������зֱ�ͨ��2.2mol CO��1mol SO2���壬�ڲ�ͬ�����½��з�Ӧ����ϵ��ѹǿ��ʱ��ı仯��ͼ��ʾ��
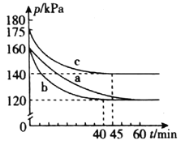
����ʵ��b�У�40 min�ﵽƽ�⣬��0��40 min��SO2��ʾ��ƽ����Ӧ����v(SO2)��_______��
����ʵ��a��ȣ�ʵ��b���ܸı������Ϊ_______________��ʵ��c���ܸı������Ϊ_________________��
��.����NH3����
(3)��һ�������£���NH3����NO��Ⱦ�ķ�Ӧԭ��Ϊ��4NH3(g)��6NO(g)5N2(g)��6H2O(l)��H����1807.98kJ��mol��1���ڸ��������У�NH3��NO�����ʵ���֮�ȷֱ�ΪX��Y��Z(����X<Y<Z)���ڲ�ͬ�¶������£��õ�NO�ѳ���(��NOת����)������ͼ��ʾ��
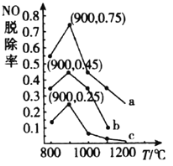
��NH3��NO�����ʵ���֮��ΪXʱ��Ӧ������Ϊ_____________(����a����b������c��)��
�ڸ�������NO�ѳ��ʾ������ߺ͵�ԭ��Ϊ__________��
��900�������£���Z��![]() ����ʼѹǿp0����4NH3(g)��6NO(g)5N2(g)��6H2O(l)��ƽ�ⳣ��Kp��_____________(�г�����ʽ����)��
����ʼѹǿp0����4NH3(g)��6NO(g)5N2(g)��6H2O(l)��ƽ�ⳣ��Kp��_____________(�г�����ʽ����)��
��.����NaCIO2��������
(4)����NaClO2�ļ�����Һ������SO2��NO2(���ʵ���֮��Ϊ1:1)�Ļ�����壬����ת��ΪNaCl����Ӧ�����ӷ���ʽΪ________________��
���𰸡�-269.2kJ��mol-1 0.01mol��L-1��min-1 ������� �����¶� c �¶ȵ���900��ʱ����Ӧ���ʽ����������¶����߷�Ӧ���ʼӿ죬NO�ѳ��������ߣ��¶ȸ���900������Ӧ�ﵽƽ��״̬����Ӧ����H<0�����������¶ȣ�ƽ�������ƶ���NO�ѳ������½� 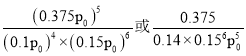 3ClO2-+4SO2+4NO2+12OH-===3Cl-+4SO42-+4NO3-+6H2O
3ClO2-+4SO2+4NO2+12OH-===3Cl-+4SO42-+4NO3-+6H2O
��������
(1)��������Ħ�����������Ķ���ɵã�
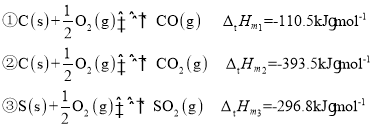
�ٸ��ݸ�˹����2(��Ӧ��-��Ӧ��)-��Ӧ�ۿɵõ�2CO(g)��SO2(g)2CO2(g)��S(s)����CO����Ӧ2CO(g)��SO2(g)2CO2(g)��S(s)���ʱ�![]() ���ʴ�Ϊ��-269.2kJ��mol-1��
���ʴ�Ϊ��-269.2kJ��mol-1��
(2)�ٽ�������Ϣ��������ʽ�У�
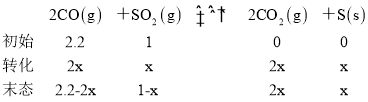
��![]() �����x=0.8����
�����x=0.8����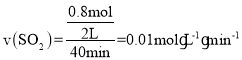 ���ʴ�Ϊ0.010.01mol��L-1��min-1��
���ʴ�Ϊ0.010.01mol��L-1��min-1��
����ʵ��a��ȣ�ʵ��b�ﵽ��ƽ��״̬����������ʱ�����̣��ı������ӦΪ�����˴�������ʵ��a��ȣ�ʵ��c�ﵽƽ��״̬�ı�������ʱ�����̣�����������ѹǿ�������¶ȣ���ϵ��Ӧ�ص㣬��������ѹǿ��ƽ�������ƶ������ҷ�Ӧ�ij̶�Ӧ������ͼ�������������¶ȣ�ƽ�������ƶ�����ͼ��������ʴ�Ϊ����������������¶ȣ�
(3)��NH3��NO�����ʵ���֮��Խ��NO���ѳ����°�������ͬ�¶��£���ͬNH3��NO���ʵ���֮�ȶ�ӦNO���ѳ��ʣ�X<Y<Z����X��Ӧ����c��Y��Ӧ����b��Z��Ӧ����a���ʴ�Ϊ��c��
��NO���ѳ��ʻ��ܵ����ʡ�ƽ���ƶ������ص�Ӱ�죬�¶ȵ���900��ʱ����Ӧ���ʽ����������¶����߷�Ӧ���ʼӿ죬NO�ѳ��������ߣ��¶ȸ���900������Ӧ�ﵽƽ��״̬����Ӧ����H<0�����������¶ȣ�ƽ�������ƶ���NO�ѳ������½����ʴ�Ϊ���¶ȵ���900��ʱ����Ӧ���ʽ����������¶����߷�Ӧ���ʼӿ죬NO�ѳ��������ߣ��¶ȸ���900������Ӧ�ﵽƽ��״̬����Ӧ����H<0�����������¶ȣ�ƽ�������ƶ���NO�ѳ������½���
��ѹǿΪp0����������a��NH3��NO�����ʵ���֮��Ϊ![]() ����NH3�ķ�ѹΪ0.4p0��NO�ķ�ѹΪ0.6p0��������ʽ�У�
����NH3�ķ�ѹΪ0.4p0��NO�ķ�ѹΪ0.6p0��������ʽ�У�
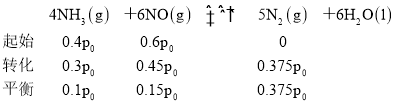
��Ӧ��ƽ�ⳣ��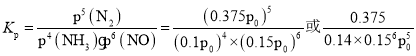 ���ʴ�Ϊ��
���ʴ�Ϊ��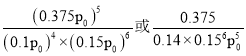 ��
��
(4)�ڼ��Ի����£�ClO2-���������ʵ�����SO2��NO2��ClO2-��ΪCl-��SO2��ΪSO42-��NO2��ΪNO3-������������ԭ��Ӧ���ɽ�����ƽ���ɵ����ӷ�Ӧ����ʽ3ClO2-+4SO2+4NO2+12OH-===3Cl-+4SO42-+4NO3-+6H2O���ʴ�Ϊ��3ClO2-+4SO2+4NO2+12OH-===3Cl-+4SO42-+4NO3-+6H2O��

 �Ķ��쳵ϵ�д�
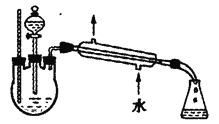
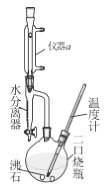
�Ķ��쳵ϵ�д�����Ŀ�������ѿ��������л�����ܼ�����ȡ�� �������ڵ��Ӽ���ϴ���������л��ϳ� ��ʵ��������������ŨH2SO4��Ӧ��ȡ��ʵ��װ������ͼ��������г�װ����ȥ����Ӧԭ�����й����ݣ�
��Ӧԭ���� 2C4H9OH ![]() C4H9OC4H9+H2O
C4H9OC4H9+H2O
����Ӧ��C4H9OH![]() C2H5CH=CH2+H2O
C2H5CH=CH2+H2O
���� | ��Է������� | �۵�/�� | �е�/�� | �ܽ��� | ||
ˮ | 50%���� | ���� | ||||
������ | 74 | -89.8 | 117.7 | �� | ���� | ������ |
������ | 130 | -98 | 142.4 | ���� | �� | |
ʵ�鲽�����£�
���ڶ�����ƿ�м���0.34mol��������4.5mLŨH2SO4,�ټ���С����ʯ��ҡ�ȡ�
�ڼ��Ƚ��裬�¶�������100~ll0�濪ʼ��Ӧ�����ŷ�Ӧ�Ľ��У���Ӧ�в�����ˮ���������ռ���ˮ���������²㣬�ϲ��л�����ˮ������֧��ʱ�����ɷ�����ƿ����������Ӧ��ɡ�
�۽���ӦҺ��ȴ��������ˮ��50%����ϴ�ӡ�ˮϴ�ӣ�������ˮ�Ȼ��Ƹ�����ˣ����������ѵ�����ΪWg��
��ش�
��1���Ʊ������ѵķ�Ӧ������____________������a��������_________��
��2���������ҩƷ������˳���ǣ��ȼ�______�������������ŨH2SO4��������ʯ��������___________________��
��3���������Ϊ���ٸ���Ӧ�������¶�Ӧ������_________��Ϊ�ˡ�ʹ��ˮ���������Ϸ����ˮ��Ŀ����________������жϷ�Ӧ�Ѿ���ɣ���_____ʱ��������Ӧ��ɣ�����ֹͣʵ�顣
��4�����������50%����ϴ�ӵ�Ŀ����Ϊ�˳�ȥ______________����ʵ���У������ѵIJ���Ϊ_____���г���W�ı���ʽ���ɣ���
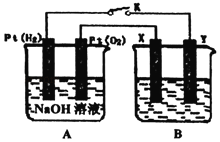
����Ŀ��һ�������£���ʵ�������л���֮���ת������ѡ�Լ���ȷ����( )
ѡ�� | ����ת�� | �Լ� |
A |
| �������� |
B |
|
|
C |
| Ũ�����Ũ����Ļ����Һ |
D |
| ������Ȼ�̼��Һ |
A.AB.BC.CD.D
����Ŀ������������һ����Ҫ�Ļ���ԭ�ϣ��㷺����ҩ��Ⱦ�ϡ����ϵȹ�ҵ���������ϵõ��������ݣ�
���� | �е�/�� | �ܶ�/ | ��Է������� | ˮ���� |
�Ҵ� | 78.0 | 0.8 | 46 | ���� |
���� | 118.0 | 1.1 | 60 | ���� |
�������� | 77.5 | 0.9 | 88 | �� |
���� | 34.6�� | 0.7 | 74 | �� |
Ũ����(98%) | 338.0 | 1.8 | 98 | ���� |
��ˮ�Ȼ��� | �����Ҵ��γ�������ˮ��CaCl2��6C2H5OH | |||
��ش��������⣺
(1)ʵ���ҳ�����ͼװ�����Ʊ�����������
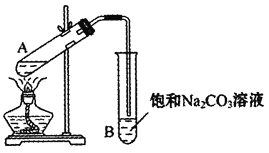
�����Ʒ�Ӧ���Һʱ���Ҵ����������Ũ����Ļ��˳����________��Ũ����Է�Ӧ�д����ã��������Ũ�����̫��Ҳ����̫�٣�ԭ����________��
�ڷ�ֹ����ʱҺ�屩�У���Ҫ���Թܼ������Ƭ���������һ��ʱ����������˼����Ƭ��Ӧ�ò�ȡ����ȷ������________��
A���������� B����ȴ�� C�����貹�� D����������
��ʵ���б���̼������Һ��������________��
(2)��Ʒ��������Һ�����Թ�B�з���������������г�����һ�������Ҵ������Ѻ�ˮ�����������������м�����ˮ�Ȼ��ƣ���ȥ________(������)��Ȼ���ټ�����ˮ�����Ƴ�ȥˮ��������________(���������)���õ��ϴ���������������
(3)��ʵ������30 g������46 g�Ҵ���Ӧ�����ʵ�ʵõ�������������������30.8 g�����ʵ�������������IJ�����________��(����ָ����ij���������ʵ�ʲ��������۲����ı�ֵ)
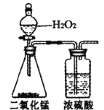
(4)��һ��ѧС�������ͼ��ʾ��װ����ȡ��������(����̨�����С�����װ�þ�����ȥ)����װ�ú���ͼװ����ȵ��ŵ���________(д��һ������)��