题目内容
15.X、Y、Z、R、W五种元素分布在三个不同的短周期,它们的原子序数依次增大.YR2是主要的温室气体,W是短周期中金属性最强的元素.甲是W的最高价氧化物的水化物,乙是X、Z组成的最简单化合物.(1)Z元素在周期表中位于第2周期,第VA族.
(2)甲含有的化学键有离子键、共价键.
(3)比较Y、R、W原子半径的大小:O<C<Na(填元素符号).
(4)一定条件下,X单质和R单质在甲的浓溶液中可以形成燃料电池,该燃料电池的正极的反应式是O2+2H2O+4e-=4OH-.
(5)工业上生产乙,若每生成a mol乙时放出b kJ热量,则该反应的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-$\frac{2b}{a}$kJ•mol-1.
分析 YR2是主要的温室气体,应为CO2,则Y为C元素,R为O元素,Y、Z、R原子序数依次增大,则Z为N元素,W是短周期中金属性最强的元素,应为Na元素,X、Y、Z、R、W五种元素分布在三个不同的短周期,则X应为第一周期元素H,甲是W的最高价氧化物的水化物,应为NaOH,乙是X、Z组成的最简单化合物,应为NH3,根据元素对应单质、化合物的结构和性质结合元素周期律知识解答该题.
解答 解:YR2是主要的温室气体,应为CO2,则Y为C元素,R为O元素,Y、Z、R原子序数依次增大,则Z为N元素,W是短周期中金属性最强的元素,应为Na元素,X、Y、Z、R、W五种元素分布在三个不同的短周期,则X应为第一周期元素H,甲是W的最高价氧化物的水化物,应为NaOH,乙是X、Z组成的最简单化合物,应为NH3,则
(1)Z为N元素,原子序数为7,原子核外有2个电子层,最外层电子数为5,位于周期表第二周期VA族,故答案为:2;VA;
(2)甲为NaOH,为离子化合物,含有离子键,NaOH中O-H为共价键,故答案为:离子键、共价键;
(3)O和C位于同一周期,C原子半径大于O,Na位于第三周期,比O、C多了一个电子层,原子半径最大,所以三者原子半径大小关系为:Na>C>O,故答案为:O、C、Na;
(4)碱性氢氧燃料电池中,氧气在正极发生还原反应生成OH-,电极反应式为O2+2H2O+4e-=4OH-,故答案为:O2+2H2O+4e-=4OH-;
(5)若每生成a molNH3时放出b kJ热量,则生成1molNH3放出$\frac{b}{a}$kJ的能量,所以合成氨的热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-$\frac{2b}{a}$ kJ•mol-1,
故答案为:N2(g)+3H2(g)?2NH3(g)△H=-$\frac{2b}{a}$ kJ•mol-1
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及原电池、热化学、元素周期律等知识点,明确周期表结构、原子结构、物质性质及元素周期律即可解答,题目难度不大.

 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案①H2O(g)═H2O(l)△H=-Q1kJ.mol-1
②C2H5OH(g)═C2H5OH(1)△H=-Q2kJ.mol-1
③C2H5OH(g)═302(g)=2C02(g)+3H20(g)△H=-Q3 kJ.mol-1
下列判断正确的是( )
| A. | 酒精的燃烧热AH=-Q3 kJ•mol-1 | |
| B. | 由③可知1molC2H5OH(g)的能量高于2molC02(g)和3 molH20(g)的总能量 | |
| C. | H20(g)→H20( 1)释放出了热量,所以该过程为放热反应 | |
| D. | 23g液体酒精完全燃烧生成C02(g)和H20( 1),释放热量为(0.5Q3-0.5Q2+1.5Q1)kJ |
| A. | 乙炔的最简式:CHCH | B. | 甲基苯的官能团为: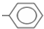 | ||
| C. | 丙烷分子的球棍模型示意图: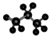 | D. | -CH3(甲基)的电子式为: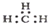 |
| A. | 液态HCl、固体NaCl均不导电,所以HCl和NaCl均是非电解质 | |
| B. | NH3、SO3的水溶液均导电,所以NH3、SO3均是电解质 | |
| C. | 常见的酸、碱和大部分盐都是强电解质 | |
| D. | 强电解质与弱电解质的本质区别,是其在水溶液中的电离程度不同 |
| A. |
| B. |
| C. |
| D. |
|
 .
.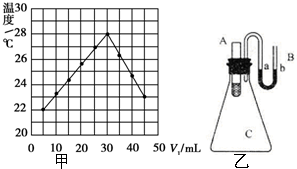 实验题:将V1 mL 1.0mol•L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始保持V1+V2=50mL).请按要求填空:
实验题:将V1 mL 1.0mol•L-1HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始保持V1+V2=50mL).请按要求填空: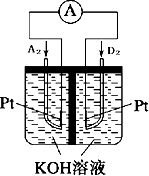 A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答:
A、B、C、D、E、F、G均为短周期元素,原子序数依次递增.A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E是短周期中金属性最强的元素,F与G位置相邻,G是同周期元素中原子半径最小的元素.请用化学用语回答: .
.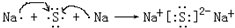 .
.