题目内容
【题目】利用钛白工业的副产物硫酸亚铁[含Ti(SO4)2及少量Fe2(SO4)3]制取铁红的工艺流程如图所示。
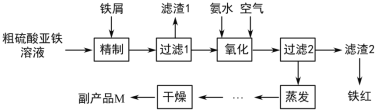
(1)加热近沸条件下“精制”硫酸亚铁的过程中,Ti4+会与水作用生成偏钛酸(H2TiO3)沉淀,此反应的离子方程式为__________,加入铁屑的作用是__________(用离子方程式表示)。
(2)“氧化”工序中发生反应的化学方程式有________。
(3)滤渣2能溶于酸和浓强碱,不溶于水。洗涤滤渣2最好选用的试剂是______(填写序号)。
a 稀硫酸 b 稀盐酸 c 浓NaOH溶液 d 蒸馏水
(4)副产品M的化学式为_________,由滤液得到M的操作为蒸发浓缩、_____、_____、洗涤、干燥。
【答案】TiO2++2H2O![]() H2TiO3↓+2H+ 2Fe3++Fe = 3Fe2+ FeSO4+2 NH3·H2O = Fe(OH)2↓+(NH4)2SO4;4Fe(OH)2+O2+2H2O = 4Fe(OH)3 d (NH4)2SO4 冷却结晶 过滤
H2TiO3↓+2H+ 2Fe3++Fe = 3Fe2+ FeSO4+2 NH3·H2O = Fe(OH)2↓+(NH4)2SO4;4Fe(OH)2+O2+2H2O = 4Fe(OH)3 d (NH4)2SO4 冷却结晶 过滤
【解析】
副产物硫酸亚铁[含Ti(SO4)2及少量Fe2(SO4)3],溶解时发生TiO2++2H2O![]() H2TiO3↓+2H+,溶液中加入铁屑时,发生2Fe3++Fe═3Fe2+,过滤分离出滤渣1为H2TiO3及过量Fe,加氨水发生FeSO4+2NH3H2O═Fe(OH)2↓+(NH4)2SO4,氧化时发生4Fe(OH)2+O2+2H2O═4Fe(OH)3,过滤分离出滤渣2为Fe(OH)3,Fe(OH)3分解生成铁红,滤液含硫酸铵,蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到M为(NH4)2SO4 ,以此来解答。
H2TiO3↓+2H+,溶液中加入铁屑时,发生2Fe3++Fe═3Fe2+,过滤分离出滤渣1为H2TiO3及过量Fe,加氨水发生FeSO4+2NH3H2O═Fe(OH)2↓+(NH4)2SO4,氧化时发生4Fe(OH)2+O2+2H2O═4Fe(OH)3,过滤分离出滤渣2为Fe(OH)3,Fe(OH)3分解生成铁红,滤液含硫酸铵,蒸发浓缩、冷却结晶、过滤、洗涤、干燥得到M为(NH4)2SO4 ,以此来解答。
(1)加热近沸条件下“精制”硫酸亚铁的过程中,Ti4+会与水作用生成偏钛酸(H2TiO3)沉淀,此反应的离子方程式为TiO2++2H2O![]() H2TiO3↓+2H+;加入铁屑的可将三价铁还原成亚铁离子,方程式为2Fe3++Fe═3Fe2+;
H2TiO3↓+2H+;加入铁屑的可将三价铁还原成亚铁离子,方程式为2Fe3++Fe═3Fe2+;
(2)根据分析可知“氧化”工序中发生反应的化学方程式有FeSO4+2 NH3H2O═Fe(OH)2↓+(NH4)2SO4、4Fe(OH)2+O2+2H2O═4Fe(OH)3;
(3)滤渣2能溶于酸和浓强碱,不溶于水,为了减少损失,洗涤滤渣2最好选用的试剂是蒸馏水;
(4)副产品M的化学式为(NH4)2SO4 ,由滤液得到M的操作为蒸发浓缩、冷却结晶、过滤、洗涤、干燥。

 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案