题目内容
【题目】NH3可用于生产硝酸和尿素。
(1)生产硝酸:
①NH3催化氧化是工业制硝酸的第一步反应,其化学方程式是______________。
②除此之外,相同条件下还可能发生以下副反应:
4NH3(g)+4O2(g)=2N2O(g)+6H2O(g) ![]()
4NH3(g)+3O2(g)=2N2O(g)+6H2O(g) ![]()
两个副反应在理论上趋势均很大,但实际生产中影响并不大,原因是______________。
(2)生产尿素:
①尿素的合成分两步进行;
a.2NH3(g)+CO2(g)![]() NH2COONH4(l)
NH2COONH4(l) ![]()
b.NH2COONH4(l)![]() CO(NH2)2(l)+H2O(l)
CO(NH2)2(l)+H2O(l) ![]()
则总反应2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)的
CO(NH2)2(l)+H2O(l)的![]() =_____________。
=_____________。
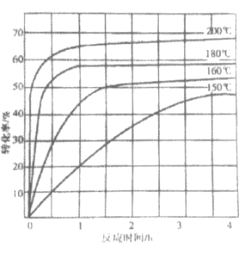
②下图为n(NH3):n(CO2)=4:1时,温度对CO2的转化率的影响。解释温度升高CO2的平衡转化率增大的原因:______________。
③测定尿素样品含氮量的方法如下:取a g尿素样品,将所含氮完全转化为NH3,所得NH3用过量的v1 mL c1 mol·L-1 H2SO4溶液吸收完全,剩余H2SO4用v2 mL c2 mol·L-1 NaOH溶液恰好中和,则尿素样品中氮元素的质量分数是______________。
【答案】4NH3+5O2![]() 4NO+6H2O 使用催化剂提高氨的催化反应的选择性
4NO+6H2O 使用催化剂提高氨的催化反应的选择性 ![]() 升高温度,反应b正向移动
升高温度,反应b正向移动 ![]()
【解析】
(1)①工业制硝酸是氨的催化氧化,第一步为氨气催化氧化为NO和水;
②催化剂具有高效性、唯一性和选择性;
(2)①根据盖斯定律可知a+b即可得到总反应式;
②温度升高,平衡向吸热反应方向移动;
③测定溶液中尿素的含量,取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1mLc1mol/L的H2SO4溶液吸收完全,产物为(NH4)2SO4,剩余H2SO4用V2mLc2mo/LNaOH溶液恰好中和,则参与吸收氨气的硫酸的物质的量为(c1V1![]() c2V2)×103mol,吸收氨气的反应为2NH3+H2SO4═(NH4)2SO4,根据N元素守恒予以解答。
c2V2)×103mol,吸收氨气的反应为2NH3+H2SO4═(NH4)2SO4,根据N元素守恒予以解答。
(1)①工业制硝酸是氨的催化氧化,第一步为氨气催化氧化为NO和水,发生反应的化学方程式为4NH3+5O2![]() 4NO+6H2O;
4NO+6H2O;
②结合催化剂的选择性,使用催化剂提高氨的催化反应的选择性,则两个副反应在理论上趋势均很大,但实际生产中影响并不大;
(2)①已知:a.2NH3(g)+CO2(g)![]() NH2COONH4(l)△H=-117kJ/mol;b.NH2COONH4(l)
NH2COONH4(l)△H=-117kJ/mol;b.NH2COONH4(l)![]() CO(NH2)2(l)+H2O(l)△H=+15kJ/mol,根据盖斯定律,a+b得总反应式为2NH3(g)+CO2(g)
CO(NH2)2(l)+H2O(l)△H=+15kJ/mol,根据盖斯定律,a+b得总反应式为2NH3(g)+CO2(g)![]() CO(NH2)2(l)+H2O(l)△H=-102kJ/mol;
CO(NH2)2(l)+H2O(l)△H=-102kJ/mol;
②当n(NH3):n(CO2)=4:1时,温度升高,CO2的平衡转化率增大是因为反应b温度升高时,平衡向正方向移动,而对反应a减小生成物,同样促进平衡正向移动;
③取ag尿素溶液,将所含氮完全转化为NH3,所得NH3用过量的V1mLc1mol/L的H2SO4溶液吸收完全,产物为(NH4)2SO4,发生的反应为2NH3+H2SO4═(NH4)2SO4,剩余H2SO4用V2mLc2mo/LNaOH溶液恰好中和,则参与吸收氨气的硫酸的物质的量为(c1V1![]() c2V2)×103mol,根据反应关系,氨气的物质的量为n(NH3)=2×(c1V1
c2V2)×103mol,根据反应关系,氨气的物质的量为n(NH3)=2×(c1V1![]() c2V2)×103molmol=(2c1V1-c2V2)×10-3mol,根据N元素守恒,尿素中氮元素的物质的量为n(N)=n(NH3)=(2c1V1-c2V2)×10-3mol,则尿素中氮元素的质量分数是w=
c2V2)×103molmol=(2c1V1-c2V2)×10-3mol,根据N元素守恒,尿素中氮元素的物质的量为n(N)=n(NH3)=(2c1V1-c2V2)×10-3mol,则尿素中氮元素的质量分数是w=![]() ×100%=
×100%=![]() ×100%。
×100%。