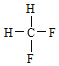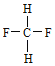题目内容
【题目】生活中处处有化学,下列有关说法正确的是
A.天然弱碱性水呈碱性的原因是其中含有较多的Mg2+、Ca2+等离子
B.焊接时用NH4Cl溶液除锈与盐类水解无关
C.生活中用电解食盐水的方法制取消毒液,运用了盐类的水解原理
D.在滴有酚酞的Na2CO3溶液中慢慢滴入BaCl2溶液,溶液的红色逐渐褪去
【答案】D
【解析】
试题A.天然弱碱性水呈碱性的原因是其中含有较多的CO32-,该离子在水中发生水解反应消耗水电离产生的H+,最终当达到平衡时,水中c(OH-)>c(H+),错误;B.焊接时用NH4Cl溶液除锈是由于该盐是强酸弱碱盐,NH4+发生水解反应小于水电离产生的OH-,当最终达到平衡时,水中c(OH-)<c(H+),溶液显酸性,H+与金属氧化物发生反应产生可溶性的物质,从而达到除锈的目的,与盐类水解有关,错误;C.生活中用电解食盐水的方法制取消毒液,是由于发生反应:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,产生的氯气与碱发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,产生了具有杀菌消毒作用的NaClO,与盐类的水解无关,错误;D.Na2CO3是强碱弱酸盐,在溶液中CO32-发生水解反应消耗水电离产生的H+,最终当达到平衡时,水中c(OH-)>c(H+),所以滴入酚酞试液时,溶液变为红色。当向其中慢慢滴入BaCl2溶液,发生离子反应:Ba2++CO32-=BaCO3↓,使盐的水解平衡逆向移动,c(OH-)减小,所以溶液的红色逐渐褪去,正确。
Cl2↑+H2↑+2NaOH,产生的氯气与碱发生反应:Cl2+2NaOH=NaCl+NaClO+H2O,产生了具有杀菌消毒作用的NaClO,与盐类的水解无关,错误;D.Na2CO3是强碱弱酸盐,在溶液中CO32-发生水解反应消耗水电离产生的H+,最终当达到平衡时,水中c(OH-)>c(H+),所以滴入酚酞试液时,溶液变为红色。当向其中慢慢滴入BaCl2溶液,发生离子反应:Ba2++CO32-=BaCO3↓,使盐的水解平衡逆向移动,c(OH-)减小,所以溶液的红色逐渐褪去,正确。

 天天向上口算本系列答案
天天向上口算本系列答案【题目】目前我国主要采用硫酸法生产钛白(TiO2),每年产生至少100万吨钛白废液,其中含H2SO4约20%,还有少量Fe2+、TiO2+、Al3+。利用钛白废液浸出氧化锌生产七水硫酸锌,具有原料易得、工艺简单、回收率高和产品纯度高等优点。生产流程简化如下:

回答下列问题:
(1)“浸出”时发生的主要反应的离子方程式为_______。
(2)为寻找“浸出”的最佳条件,做9组对比实验得下表:
因素 | 温度/℃ | 反应时间/h | 固液比 | 产率/% |
1 | 70 | 2 | 1∶6.5 | 79.83 |
2 | 70 | 3 | 1∶7.5 | 86.18 |
3 | 70 | 4 | 1∶8.5 | 84.33 |
4 | 80 | 2 | 1∶7.5 | 83.06 |
5 | 80 | 3 | 1∶8.5 | 87.02 |
6 | 80 | 4 | 1∶6.5 | 95.38 |
7 | 90 | 2 | 1∶8.5 | 83.58 |
8 | 90 | 3 | 1∶6.5 | 88.95 |
9 | 90 | 4 | 1∶7.5 | 89.64 |
由表中数据可知,“浸出率”最高时的反应条件是_______。
(3)从生产实际考虑,调滤液的pH时选择加入石灰乳的原因是_______。
(4)常温下,按1:6固液质量比反应的浸出液中锌离子浓度最大值约为2.5mol/L,若Ksp[Zn(OH)2]=1.2×10-17,lg4.8≈0.68。则加入石灰乳调节的pH应不超过______(保留一位小数)。
(5)在加热下鼔入空气时,发生反应的化学方程式是___,此时TiO2+也会水解生成H2TiO3沉淀,发生反应的离子方程式为_____。
(6)加热下加入H2O2目的是进一步氧化除杂,氧化产物为__。抽滤得到的滤渣主要成分有___和H2TiO3(填化学式)。