题目内容
【题目】随着现代科学技术的快速发展,防腐蚀技术也在不断提高。
Ⅰ.金属的腐蚀原理
(1)中性环境中多为吸氧腐蚀,其正极的电极反应为________。
(2)析氢腐蚀和吸氧腐蚀的均会导致体系中c(OH-)________(填“增大”、“不变”或“减小”)。
(3)不同酸性介质中,金属腐蚀原理并不相同。下图是密闭容器中,生铁在pH=2和pH=4的盐酸中压强随时间的变化过程。
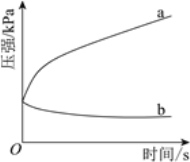
图中代表pH=2的曲线是________(填“a”或“b”)。
Ⅱ.金属的电化学防护
(1) 富锌涂料是使用广泛的防锈底漆,涂层中锌对钢铁保护的原理是________。
(2) 缓蚀剂是能明显减缓或阻止金属腐蚀的物质,钼酸钠(Na2MoO4)和磷酸二氢锌[Zn(H2PO4)]2是常用自来水(pH范围6.5~8.8)介质碳钢缓蚀剂。
①钼酸钠(Na2MoO4)在电极表面被还原为MoO2形成保护膜,减缓腐蚀,该电极反应为______;同时,MoO42-能与Fe2+反应生成难溶的Fe2O3和MoO2,沉积在碳钢表面减缓腐蚀。写出MoO42-与Fe2+反应的离子反应方程式:_______。
②电化学反应可使缓蚀剂成分中的Zn(H2PO4)2转化为难溶性的Zn3(PO4)2,形成保护膜,减缓腐蚀。用平衡移动原理解释发生转化原因________。
【答案】O2+2H2O+4e-=4OH- 增大 a 形成原电池,锌失去电子作负极,铁为正极,被保护 MoO42-+2e-+2H2O=MoO2+4OH- MoO42-+2Fe2++2OH-=MoO2+Fe2O3+H2O 正极反应使c(OH-)增大, 使平衡H2PO4-![]() HPO42-+H+ HPO42-
HPO42-+H+ HPO42-![]() PO43-+H+正向移动,有利于2PO43-+3Zn2+
PO43-+H+正向移动,有利于2PO43-+3Zn2+![]() Zn3(PO4)2↓生成。
Zn3(PO4)2↓生成。
【解析】
I.(1)中性环境中金属发生的腐蚀为吸氧腐蚀,在正极上溶解在溶液中的氧气获得电子,变为OH-;
(2)析氢腐蚀是在强酸性溶液中,H+获得电子变为H2逸出,吸氧腐蚀是溶解在溶液中的氧气获得电子,变为OH-,结合溶液中Kw不变分析体系中c(OH-)变化;
(3)气体增多导致体系的压强增大;气体减少,导致体系的压强减小,结合溶液的pH大小分析判断;
II.(1)根据金属活动性Zn>Fe,依据原电池反应原理分析;
(2)①根据元素的化合价变化,判断电极反应;根据电子得失数目相等,书写离子方程式;
②Zn(H2PO4)2在溶液中电离产生Zn2+和H2PO4-,根据H2PO4-的电离平衡移动分析产生难溶性的Zn3(PO4)2。
I.(1)中性环境中,溶液中H+浓度较小,金属发生的腐蚀为吸氧腐蚀,在正极上溶解在溶液中的氧气获得电子,变为OH-,所以正极的电极反应式为:O2+2H2O+4e-=4OH-;
(2)析氢腐蚀是在强酸性溶液中,溶液中c(H+)较大,溶液中的H+获得电子变为H2逸出,H+放电使溶液中c(H+)降低,由于在溶液中存在水的电离平衡,温度不变,Kw=c(H+)c(OH-)不变,c(H+)降低,则溶液中c(OH-)增大;而金属发生吸氧腐蚀时,是溶解在溶液中的氧气获得电子,变为OH-,使体系中c(OH-)增大。因此无论是析氢腐蚀还是吸氧腐蚀在,最终都导致溶液中c(OH-)增大;
(3)溶液的pH=2时是强酸性环境,发生的为析氢腐蚀,产生气体,使体系的气体压强增大。根据图示可知:a是随着反应的进行体系的压强增大,说明反应产生了气体,使体系的压强增大,发生的为析氢腐蚀,所以曲线a是在pH=2的强酸性环境发生的腐蚀;
II.(1)由于金属活动性Zn>Fe,所以Zn、Fe及周围的电解质溶液构成原电池,Zn作负极,失去电子被氧化;而Fe作原电池的正极,被保护;
(2)①在钼酸钠(Na2MoO4)中Mo元素化合价为+6价,在阴极上获得电子变为+4价的MoO2,附着在电极上,在电极表面形成保护膜,电极反应式为:MoO42-+2e-+2H2O=MoO2+4OH-;
MoO42-能与Fe2+反应生成难溶的Fe2O3和MoO2,根据电子守恒、电荷守恒、原子守恒,可得该反应的离子方程式为:MoO42-+2Fe2++2OH-=MoO2+Fe2O3+H2O;
②在电化学反应中,在正极上反应产生的OH-使溶液中c(OH-)增大,使平衡H2PO4-![]() HPO42-+H+及HPO42-
HPO42-+H+及HPO42-![]() PO43-+H+的电离平衡正向移动,导致溶液中c(PO43-)增大,有利于发生反应2PO43-+3Zn2+
PO43-+H+的电离平衡正向移动,导致溶液中c(PO43-)增大,有利于发生反应2PO43-+3Zn2+![]() Zn3(PO4)2↓,形成Zn3(PO4)2沉淀。
Zn3(PO4)2↓,形成Zn3(PO4)2沉淀。

【题目】某同学用标准![]() 溶液来测定未知浓度的盐酸的浓度:
溶液来测定未知浓度的盐酸的浓度:
(1)配制250mL 0.5mol/L的![]() 溶液所需的玻璃仪器为________________________。
溶液所需的玻璃仪器为________________________。
(2)用滴定管准确量取20.00mL未知浓度的盐酸于锥形瓶中,加入酚酞作指示剂,用![]() 溶液滴定到终点。
溶液滴定到终点。
该同学进行了三次实验,实验数据如下表:
实验编号 | 盐酸的体积(mL) | 标准 |
1 | 20.00 | 18.20 |
2 | 17.10 | |
3 | 16.90 |
滴定中误差较大的是第______次实验,造成这种误差的可能原因是______(填选项编号)
a、在盛装未知浓度的盐酸之前锥形瓶里面有少量蒸馏水,未烘干
b、滴定管在盛装标准![]() 溶液前未润洗
溶液前未润洗
c、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
溶液的滴定管尖嘴部分有气泡,滴定终点读数时未发现气泡
d、滴定开始前盛装标准![]() 溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
溶液的滴定管尖嘴部分没有气泡,在滴定终点读数时发现尖嘴部分有气泡
e、滴定过程中,锥形瓶摇荡得太剧烈,以致有些液滴飞溅出来
f、达到滴定终点时,俯视溶液凹液面最低点读数
g、滴定到终点时,溶液颜色由无色变到了红色
(3)该同学所测得盐酸的物质的量浓度为______________________(结果保留三位小数)。