题目内容
12.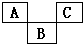 如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答:
如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答:(1)写出元素符号:AN;
(2)C的离子结构示意图:
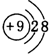 ;B的最高价氧化物对应化物的化学式为H2SO4.
;B的最高价氧化物对应化物的化学式为H2SO4.(3)A、B、C三种元素的气态氢化物中最稳定的是HF(填氢化物化学式)
分析 A、B、C均为短周期元素,由元素在周期表中位置,可知A、C位于第二周期,B位于第三周期,设B原子序数为x,则A原子序数为x-9、C原子序数为x-7,A、C两元素的原子核外电子数之和等于B原子的质子数,则x-9+x-7=x,解得x=16,所以B是S元素,则A是N元素、C是F元素,据此解答.
解答 解:A、B、C均为短周期元素,由元素在周期表中位置,可知A、C位于第二周期,B位于第三周期,设B原子序数为x,则A原子序数为x-9、C原子序数为x-7,A、C两元素的原子核外电子数之和等于B原子的质子数,则x-9+x-7=x,解得x=16,所以B是S元素,则A是N元素、C是F元素.
(1)由上述分析可知,A为N元素,故答案为:N;
(2)C是F元素,其离子核外有10个电子,有2个电子层,最外层电子数是8,F-离子结构示意图为 ;B为S元素,最高价氧化物对应化物的化学式为H2SO4,故答案为:
;B为S元素,最高价氧化物对应化物的化学式为H2SO4,故答案为: ;H2SO4;
;H2SO4;
(3)三种元素中F元素非金属性最强,故HF最稳定,故答案为:HF.
点评 本题考查元素的位置结构性质关系应用,题目难度不大,推断元素是解题关键,注意理解掌握同主族元素原子序数关系.

练习册系列答案
 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案
相关题目
2.下列物质属于纯净物的是( )
| A. | 氯水 | B. | 氢氧化铁胶体 | C. | 漂白粉 | D. | 液氯 |
3.下列对各组离子或物质是否能够大量共存的判断及解释一定正确的是( )
| A | 25℃时,由水电离出来的c(H+)和c(OH-)的乘积为1×10-2 4的某溶液中: Fe2+、NO3-、AlO2-、Na+ | 不能共存 | 发生反应: 3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O |
| B | 澄清石灰水中: Ca2+、K+、CH3COO-、HCO3- | 不能共存 | 发生反应: Ca2++OH-+HCO3-=CaCO3↓+H2O |
| C | 常温常压下,空气中: NH3、NO、H2、CO2 | 可以共存 | 不能发生反应 |
| D | 银氨溶液中: K+、Na+、NO3-、Cl- | 可以共存 | 不能发生反应 |
| A. | A | B. | B | C. | C | D. | D |
20.下列属于加成反应的是( )
| A. | 乙醇与乙酸在浓硫酸加热条件下反应 | |
| B. | 乙烯通入溴的四氯化碳溶液 | |
| C. | 苯与浓硝酸、浓硫酸的混合物共热 | |
| D. | 乙醇在铜粉存在下与氧气反应 |
7.相同温度和压强下,在容积为2L的密闭容器中发生反应:2HI(g)?H2(g)+I2(g),达到平衡状态的标志是( )
| A. | c(H2)保持不变 | |
| B. | 拆开2 mol H-I共价键,同时生成1 mol H-H共价键 | |
| C. | HI、H2、I2的浓度比为2:1:1 | |
| D. | 正反应和逆应都已停止 |
17.苯环上有两个取代基的C9H12,其一氯代物的同分异构体共有( )
| A. | 9种 | B. | 16种 | C. | 19种 | D. | 22种 |
4.下列表述正确的是( )
| A. | 醛基的结构简式-COH | B. | 聚丙烯的结构简式 | ||
| C. | 羟基的电子式  | D. | 乙醇的结构简式C2H6O |
1.中国科学家首次在世界上发现铂的一种新原子78202Pt,下列说法不正确的是( )
| A. | 质量数202 | B. | 核外电子数202 | C. | 原子序数78 | D. | 核内有124个中子 |
2.短周期元素W、X、Y和Z的原子序数依次增大.W原子是半径最小的原子,非金属元素X形成的一种单质能导电,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )
| A. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| B. | 元素X与W形成的共价化合物有很多种 | |
| C. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |