题目内容
2.短周期元素W、X、Y和Z的原子序数依次增大.W原子是半径最小的原子,非金属元素X形成的一种单质能导电,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍.下列说法错误的是( )| A. | 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成 | |
| B. | 元素X与W形成的共价化合物有很多种 | |
| C. | 元素W、X的氯化物中,各原子均满足8电子的稳定结构 | |
| D. | 元素Z可与元素X形成共价化合物XZ2 |
分析 短周期元素W、X、Y和Z的原子序数依次增大.W原子是半径最小的原子,则W为H元素;Y是地壳中含量最高的金属元素,则为Al元素;非金属元素X形成的一种单质能导电,则该单质为石墨,所以X为C元素;Z原子的最外层电子数是其电子层数的2倍,而且原子序数比Al大,则Z的电子排布为2、8、6,所以Z为S元素,结合对应单质、化合物的性质以及元素周期律知识解答该题.
解答 解:短周期元素W、X、Y和Z的原子序数依次增大.W原子是半径最小的原子,则W为H元素;Y是地壳中含量最高的元素,则为O元素;非金属元素X形成的一种单质能导电,则该单质为石墨,所以X为C元素;Z原子的最外层电子数是其电子层数的2倍,而且原子序数比O大,则Z的电子排布为2、8、6,所以Z为S元素,
A.Y为Al元素,Al与氢氧化钠溶液或盐酸反应均有氢气生成,故A正确;
B.C与H可以形成烷烃、烯烃、炔烃等,则元素X与W形成的共价化合物有很多种,故B正确;
C.元素W为H,X为C,二者的氯化物中,HCl中的H原子最外层只有2个电子,不满足8电子的稳定结构,故C错误;
D.元素S可与元素C形成共价化合物CS2,故D正确.
故选C.
点评 本题考查原子结构与元素周期律的关系,题目侧重于原子结构与元素周期律的递变规律的考查,题目难度不大,注意根据原子结构特点明确元素的种类为解答该题的关键,题目难度中等.

练习册系列答案
 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案
相关题目
13.下列各组物质中化学键的类型完全相同的是( )
| A. | NaCl MgCl2 Na2O | B. | H2O Na2O ? CO2 | ||
| C. | CaCl2 ? NaOH H2SO4 | D. | NH4Cl H2O CO2 |
17.下列有关两种微粒ZAX和ZA+1X+的叙述正确的是( )
| A. | 一定都是由质子、中子、电子组成的 | |
| B. | 化学性质几乎完全相同 | |
| C. | 核电荷数和核外电子数一定相等 | |
| D. | 质子数一定相同,质量数和中子数一定不相同 |
14.雷美替胺是首个没有列为特殊管制的非成瘾失眠症治疗药物,合成该有机物过程中涉及如下转化,下列说法正确的是( )


| A. | 可用溴水区分化合物Ⅱ和化合物Ⅲ | |
| B. | 化合物Ⅰ中所有原子可能在同一平面 | |
| C. | 化合物Ⅰ、Ⅱ、Ⅲ均能与NaHCO3溶液发生反应 | |
| D. | 1 mol化合物Ⅰ最多能与3 mol H2发生加成反应 |
11.已知Ⅰ、Ⅱ反应在一定条件下焓变及平衡常数如下:
2H2(g)+S2(g)?2H2S(g) K1;△H1 (Ⅰ)
3H2(g)+SO2(g)?2H2O(g)+H2S(g) K2;△H2 (Ⅱ)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)?S2(g)+4H2O(g)的△H=△H2×2-△H1
(2)回答下列反应(I)的相关问题:
①温度为T1,在1L恒容容器中加入1.8molH2、1.2molS2,10min时反应达到平衡.测得10min内v(H2S)=0.08mol•L-1•min-1,则该条件下的平衡常数为0.8L•mol-1,若此时再向容器中充入H2(g)、S2(g)、H2S(g)各0.8mol,则平衡移动方向为正向(填“正向”、“逆向”或“不移动”);
②温度为T2时T2>T1,在1L恒容容器中也加入1.8molH2(g)、1.2molS2(g),反应建立平衡时测得S2(g)的转化率为25%,据此判断△H1<0(填“>”或“<”),与T1时相比,平衡常数K2减小(填“增大”、“减小”或“不变”).
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等.
①已知Na2SO3水溶液显碱性,原因是SO32-+H2O?HSO3-+OH-(写出主要反应的离子方程式),该溶液中,c(Na+)<2c(SO32-)+c(HSO3-)+c(OH-)(填“>”、“<”或“='’).
②在某NaHSO3、Na2SO3混合溶液中,HSO3-和SO32-物质的量之比与溶液pH变化如下表所示(部分):
根据表中数据,求盐Na2SO3溶液中SO32-的水解平衡常数K(SO32-)=10-6.2mol•L-1.
2H2(g)+S2(g)?2H2S(g) K1;△H1 (Ⅰ)
3H2(g)+SO2(g)?2H2O(g)+H2S(g) K2;△H2 (Ⅱ)
(1)用△Hl、△H2表示反应4H2(g)+2SO2(g)?S2(g)+4H2O(g)的△H=△H2×2-△H1
(2)回答下列反应(I)的相关问题:
①温度为T1,在1L恒容容器中加入1.8molH2、1.2molS2,10min时反应达到平衡.测得10min内v(H2S)=0.08mol•L-1•min-1,则该条件下的平衡常数为0.8L•mol-1,若此时再向容器中充入H2(g)、S2(g)、H2S(g)各0.8mol,则平衡移动方向为正向(填“正向”、“逆向”或“不移动”);
②温度为T2时T2>T1,在1L恒容容器中也加入1.8molH2(g)、1.2molS2(g),反应建立平衡时测得S2(g)的转化率为25%,据此判断△H1<0(填“>”或“<”),与T1时相比,平衡常数K2减小(填“增大”、“减小”或“不变”).
(3)常温下,用SO2与NaOH溶液反应可得到NaHSO3、Na2SO3等.
①已知Na2SO3水溶液显碱性,原因是SO32-+H2O?HSO3-+OH-(写出主要反应的离子方程式),该溶液中,c(Na+)<2c(SO32-)+c(HSO3-)+c(OH-)(填“>”、“<”或“='’).
②在某NaHSO3、Na2SO3混合溶液中,HSO3-和SO32-物质的量之比与溶液pH变化如下表所示(部分):
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH | 8.2 | 7.2 | 6.2 |
12.元素性质随原子序数的递增呈周期性变化的本质是( )
| A. | 原子核外电子排布呈现周期性变化 | |
| B. | 原子的电子层数增多 | |
| C. | 元素的相对原子质量逐渐增大,量变引起质变 | |
| D. | 原子半径呈周期性变化 |
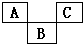 如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答:
如图示是元素周期表的一部分,A、B、C均为短周期元素,A、C两种元素的原子核外电子数之和等于B的质子数,B的原子核内质子数和中子数相等.回答: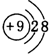 ;B的最高价氧化物对应化物的化学式为H2SO4.
;B的最高价氧化物对应化物的化学式为H2SO4. 某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题:
某学生实验小组,用稀硫酸和稀氢氧化钠溶液在如图所示的装置中,进行中和反应反应热的测定.请回答下列问题: