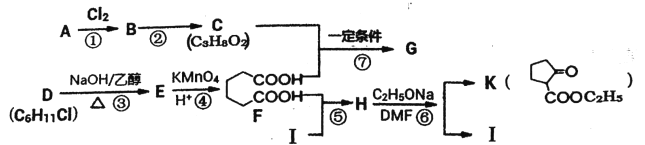
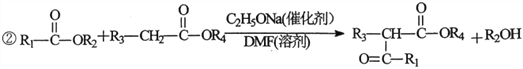
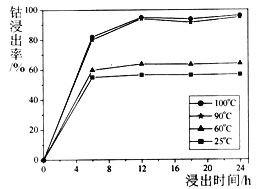
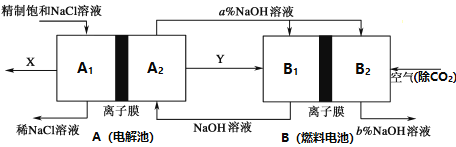
题目内容
【题目】某固体可能含有 Ba2+、NH4 + 、Cu2+、Na +、Cl -、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验:
(1)一份固体溶于水得到无色透明溶液。加入足量的 BaCl2 溶液,得到沉淀 6.63g;在沉淀中加入过量 的稀盐酸,仍有 4.66g 沉淀。
(2)另一份固体与过量的 NaOH 固体混合后充分加热,产生气体 1.344L(标准状况)。已知NH4 + OH-=NH3↑H2O ,则下列说法正确的是( )
A. 该固体中一定只含有 NH4 + 、CO32-、SO42-
B. 该固体中一定没有Cu2+、Na +、Ba2+、Cl-
C. 该固体中一定含有NH4 + 、Na +、Cl -、CO32-、SO42-
D. 若该固体中含有 Na+,则一定含有 Cl-,且二者等量
【答案】D
【解析】
根据离子共存条件分析解答。
(1)一份固体溶于水得无色透明溶液,说明不含Cu2+,加入足量BaCl2溶液,得沉淀6.63,在沉淀中加入过量稀盐酸,沉淀变成4.66g,说明沉淀一部分溶于盐酸,一部分不溶于稀盐酸,所以溶液中一定含有SO42-和 CO32-, n(SO42-)=n(BaSO4)=![]() =0.02mol,n(CO32-)=n(BaCO3)=
=0.02mol,n(CO32-)=n(BaCO3)=![]() =0.01mol;
=0.01mol;
(2)另一份固体与过量NaOH固体混合后充分加热,产生使湿润的红色石蕊试纸变蓝色的气体,即氨气1.344L即0.06mol(标准状况),所以含有铵根离子0.06mol;根据溶液中电荷守恒,其中CO32-和SO42-提供的负电荷的物质的量为:2×n(SO42-)+ 2×n(CO32-)=0.06mol,NH4+提供的正电荷的物质的量为:1×n(NH4+)=0.06mol,若固体形成的溶液中含有Na+,就一定含有Cl-,以维持溶液中的电荷平衡,故D正确。
故选D。

【题目】向 100mL BaCl2、AlCl3 和 FeCl3 的混合溶液 A 中逐滴加入 Na2SO4 和 NaOH 的混合溶液 B,产生的沉淀 的物质的量(n)和加入溶液 B 的体积(V)关系如图。

(1)当加入 B 溶液 110mL 时,溶液中的沉淀为_____(填化学式,下同),溶液中的杂质是____________________。
(2)从 90mL 至 100 mL 之间加入 10mL B 溶液时发生的离子反应方程式______。
(3)将 A、B 溶液中各溶质的物质的量浓度填入下表
溶质 | Na2SO4 | NaOH | BaCl2 | AlCl3 | FeCl3 |
c(mol/L) | ___________ | ___________ | ___________ | ___________ | ___________ |