题目内容
【题目】钴被誉为战略物资,有出色的性能和广泛的应用。以水钴矿 (主要成分为Co2O3、CoO、CuO、Fe2O3、CaO、MgO、NiO和SiO2等)为原料制备CoCl2·6H2O的工艺流程如图所示:

回答下列问题:
Ⅰ.“酸浸”
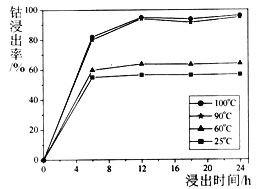
(1)钴的浸出率随酸浸时间、温度的变化关系如下图所示。综合考虑成本,应选择的最佳工艺条件为______、______;滤渣①的主要成分为_______。
(2) Co2O3与浓硫酸反应生成CoSO4的化学方程式为_________。
Ⅱ.“净化除杂”分三步完成:
(3)除铁:加入适量Na2SO4固体,析出淡黄色晶体黄钠铁矾Na2Fe6(SO4)4(OH)12离子方程式为____________。
(4)除钙、镁:加入适量NaF,当Mg2+恰好完全被除去(离子浓度等于10-5mol·L-1)时,c(Ca2+)=_____mol·L-1 (取两位有效数字)。已知:Ksp(MgF2)=7.4×10-11, Ksp(CaF2)=1.5×10-10。
(5)除铜:加入适量Na2S2O3,发生反应2CuSO4+2Na2S2O3+2H2O=Cu2S↓+S↓+2Na2SO4+2H2SO4,该反应的还原产物为___________
Ⅲ.“萃取和反萃取”
(6)“水相①”中的主要溶质是Na2SO4和________(写化学式)。
(7)实验室称取100g原料(含钴11.80%),反萃取时得到浓度为0.036mol·L-1的CoCl2溶液5L,忽略损耗,钴的产率=______(产率=![]() )。
)。
【答案】 12h 90℃ SiO2(二氧化硅) 2Co2O3+4H2SO4(浓)![]() 4CoSO4+4H2O+O2↑ 2Na++6Fe3++4SO42-+12H2O
4CoSO4+4H2O+O2↑ 2Na++6Fe3++4SO42-+12H2O![]() Na2Fe6(SO4)4(OH)12↓+12H+ 2.0×10-5(mol·L-1) -1 Cu2S、S NiSO4
Na2Fe6(SO4)4(OH)12↓+12H+ 2.0×10-5(mol·L-1) -1 Cu2S、S NiSO4 
【解析】考查化学反应原理的综合应用,(1)根据钴的浸出率随酸浸时间、温度的变化关系,推出在12h、90℃时钴的浸出率最高;根据水钴矿的成分,SiO2是酸性氧化物,不与酸反应,即滤渣①的主要成分是SiO2;(2)Co2O3中Co的化合价由+3价→+2价,化合价降低,应该是O元素被氧化成O2,因此反应方程式为2Co2O3+4H2SO4(浓) ![]() 4CoSO4+4H2O+O2↑;(3)根据生成黄钠铁矾,推出离子反应方程式为2Na++6Fe3++4SO42-+12H2O=Na2Fe6(SO4)4(OH)12↓+12H+;(4)
4CoSO4+4H2O+O2↑;(3)根据生成黄钠铁矾,推出离子反应方程式为2Na++6Fe3++4SO42-+12H2O=Na2Fe6(SO4)4(OH)12↓+12H+;(4) ,c(Mg2+)=10-5mol·L-1代入公式,求出c(Ca2+)=2.0×10-5;(5)还原产物是氧化剂被还原得出的物质,根据化学反应方程式,CuSO4中Cu的化合价由+2价→+1价,化合价降低,Na2S2O3中一部分S的化合价降低,转化成S和Cu2S中的S,即还原产物是Cu2S和S;(6)根据流程的目的,以及主要成分,推出水相①中含有溶质为Na2SO4和NiSO4;(7)根据产率的公式,得出钴的产率为
,c(Mg2+)=10-5mol·L-1代入公式,求出c(Ca2+)=2.0×10-5;(5)还原产物是氧化剂被还原得出的物质,根据化学反应方程式,CuSO4中Cu的化合价由+2价→+1价,化合价降低,Na2S2O3中一部分S的化合价降低,转化成S和Cu2S中的S,即还原产物是Cu2S和S;(6)根据流程的目的,以及主要成分,推出水相①中含有溶质为Na2SO4和NiSO4;(7)根据产率的公式,得出钴的产率为 。
。