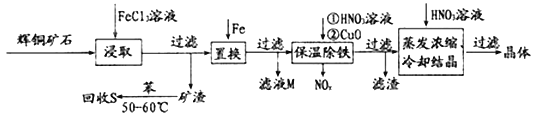
题目内容
【题目】碱式氯化铜是重要的无机杀菌剂,有多种组成,可表示为 Cua(OH)bClcxH2O。为测定某碱式氯化铜的 组成,进行下列实验:
(1)称取样品 1.1160g,用少量稀 HNO3 溶解后配成 100.00mL 溶液 A;
(2)取 25.00mL 溶液 A,加入足量 AgNO3 溶液,得 AgCl 0.1722g;
(3)另取 25.00mL 溶液 A,调节 pH 45,用浓度为 0.08000molL1 的 EDTA 标准溶液确定 A 中 Cu2+(原理为 Cu2++EDTA═EDTACu2+),消耗 EDTA 标准溶液 30.00mL。通过计算确定该样品的化学式( )
A. Cu2(OH)2Cl23H2O B. Cu2(OH)3ClH2O
C. Cu(OH)Cl2H2O D. Cu2(OH)Cl33H2O
【答案】B
【解析】
根据物质中的电荷守恒、原子守恒等原理分析解答;根据物质的量相关计算分析解答。
根据AgCl的质量为 0.1722g,可得到
n(Cl-)=n(AgCl)×![]() =
=![]() ×
×![]() =4.800×10-3mol,
=4.800×10-3mol,
由于滴定原理为:Cu2++EDTA═EDTACu2+,
可得到n(Cu2+)=n(EDTA)×![]() =0.08000mol·L-1×30.00mL×10-3L·mL-1×
=0.08000mol·L-1×30.00mL×10-3L·mL-1×![]() =9.600×10-3mol,
=9.600×10-3mol,
再根据原子守恒原理,可推断出n(OH-),即n(OH-) +n(Cl-)=2n(Cu2+),
所以2×9.600×10-3mol= n(OH-) +4.800×10-3mol,n(OH-)=1.440×10-2mol,
最后根据质量守恒,推断出
m(Cl-)=4.800×10-3mol×35.5g·mol-1=0.1704g,
m(Cu2+)=9.600×10-3mol×64g·mol-1=0.6144g,
m(OH-)=1.440×10-2mol×17g·mol-1=0.2448g,
n(H2O)=![]() =4.800×10-3mol,
=4.800×10-3mol,
可得到a∶b∶c∶x=n(Cu2+)∶n(OH-)∶n(Cl-)∶n(H2O)=2∶3∶1∶1,化学式为Cu2(OH)3Cl·H2O,故B正确;
故选B。