题目内容
(10分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。与Cl2比,ClO2不但具有更显著的杀菌能力,而且不会产生对人体有潜在危害的有机氯代物。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子
(ClO2-)。2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。
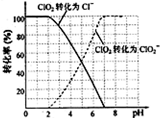
当pH≤2.0时,ClO2-也能被I-还原成Cl-。
反应生成的I2用标准Na2S2O3溶液滴定:
Na2S2O3+I2=Na2S4O6+2NaI
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3
溶液V1mL。
步骤5: 。
步骤6:再用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根据上述分析数据,测得该饮用水样中ClO2-浓度为 mol·L-1用含字母的代数式表示)
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,
该反应的氧化产物是 (填化学式)。
(1)在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑+2H2O:
用方法二制备的ClO2更适合用于饮用水的消毒,其主要原因是 。
(2)用ClO2处理过的饮用水(pH为5.5~6.5)常含有一定量对人体不利的亚氯酸根离子
(ClO2-)。2001年我国卫生部规定,饮用水中ClO2-的含量应不超过0.2mg·L-1。
饮用水中ClO2、ClO2-的含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如图所示。

当pH≤2.0时,ClO2-也能被I-还原成Cl-。
反应生成的I2用标准Na2S2O3溶液滴定:
Na2S2O3+I2=Na2S4O6+2NaI
①请写出pH≤2.0时,ClO2-与I-反应的离子方程式 。
②请完成相应的实验步骤:
步骤1:准确量取VmL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3
溶液V1mL。
步骤5: 。
步骤6:再用cmol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2mL。
③根据上述分析数据,测得该饮用水样中ClO2-浓度为 mol·L-1用含字母的代数式表示)
④若饮用水中ClO2-的含量超标,可向其中加入适量的Fe2+将ClO2-还原成Cl-,
该反应的氧化产物是 (填化学式)。
(1)方法二制备的ClO2中不含Cl2
(2) ①ClO2-+4H++4I-=Cl-+2I2+2H2O ②调节溶液的pH≤2.0
③c(V2-4V1)/4V ④Fe(OH)3
(2) ①ClO2-+4H++4I-=Cl-+2I2+2H2O ②调节溶液的pH≤2.0
③c(V2-4V1)/4V ④Fe(OH)3
(1)根据两种方法中的反应方程式可以看出,方法一制得的ClO2中含有Cl2,
会产生对人体有潜在危害的有机氯代物,而方法二制备的ClO2中不含有Cl2,
所以 用方法二制备的ClO2更适合用于饮用水的消毒。
(2)①pH≤2.0时,溶液显酸性,所以ClO2-与I-反应的离子方程式为:
ClO2-+4H++4I-=Cl-+2I2+2H2O
②根据曲线图示在pH≤2.0时, ClO2被I-还原只生成Cl-,pH≥7.0时,
ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,
所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第
一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,
所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品
水样中亚氯酸根离子的含量。
③由 2ClO2+2I-→2ClO2-+I2和Na2S2O3+I2=Na2S4O6+2NaI
得: 2ClO2- ~ Na2S2O3
n(ClO2-) c×V1/1000 n(ClO2-)=2 c×V1/1000
由ClO2-+4H++4I-=Cl-+2I2+2H2O 和Na2S2O3+I2=Na2S4O6+2NaI
得: ClO2- ~ 2Na2S2O3
n(ClO2-)总 c×V2/1000 n(ClO2-)总=1/2 c×V2/1000
原水样中ClO2-浓度=[ 1/2 c×V2/1000-2 c×V1/1000]/V/1000
=c(V2-4V1)/4V
④根据反应:4Fe2++ClO2-+2H2O→4Fe3++Cl-+4OH-,Fe3++ OH-→Fe(OH)3
所以氧化产物为Fe(OH)3、(FeCl3)
会产生对人体有潜在危害的有机氯代物,而方法二制备的ClO2中不含有Cl2,
所以 用方法二制备的ClO2更适合用于饮用水的消毒。
(2)①pH≤2.0时,溶液显酸性,所以ClO2-与I-反应的离子方程式为:
ClO2-+4H++4I-=Cl-+2I2+2H2O
②根据曲线图示在pH≤2.0时, ClO2被I-还原只生成Cl-,pH≥7.0时,
ClO2被I-还原只生成ClO2-;而用ClO2处理过的饮用水,其pH为5.5~6.5,
所以其中既含有ClO2,又含有ClO2-,若将溶液的pH调节为7.0~8.0,则第
一阶段滴定时只是ClO2被I-还原只生成ClO2-,溶液的ClO2-没有被I-还原,
所以第二阶段滴定前应调节溶液的pH≤2.0,使ClO2-与I-反应,以测定样品
水样中亚氯酸根离子的含量。
③由 2ClO2+2I-→2ClO2-+I2和Na2S2O3+I2=Na2S4O6+2NaI
得: 2ClO2- ~ Na2S2O3
n(ClO2-) c×V1/1000 n(ClO2-)=2 c×V1/1000
由ClO2-+4H++4I-=Cl-+2I2+2H2O 和Na2S2O3+I2=Na2S4O6+2NaI
得: ClO2- ~ 2Na2S2O3
n(ClO2-)总 c×V2/1000 n(ClO2-)总=1/2 c×V2/1000
原水样中ClO2-浓度=[ 1/2 c×V2/1000-2 c×V1/1000]/V/1000
=c(V2-4V1)/4V
④根据反应:4Fe2++ClO2-+2H2O→4Fe3++Cl-+4OH-,Fe3++ OH-→Fe(OH)3
所以氧化产物为Fe(OH)3、(FeCl3)

练习册系列答案
 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案
相关题目