题目内容
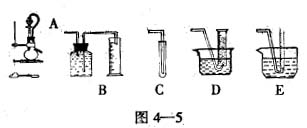
下面是实验室可制取氨气的装置和选用的试剂,其中正确的是( )
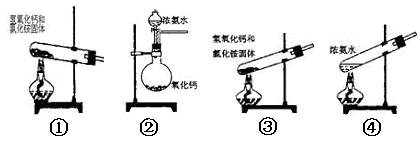

| A.①③④ | B.只有③ | C.①② | D.①②④ |
D
①可以制取氨气;②在氨水中存在平衡:NH3+H2O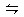 NH3·H2O
NH3·H2O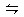 NH4++OH-,依据化学平衡移动原理,氧化钙与水反应放出大量热温度升高,使氨的溶解度减小而放出;氧化钙与水反应消耗水,促使氨放出;氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;③中试管口应略向下倾斜;④在氨水中存在平衡:NH3+H2O
NH4++OH-,依据化学平衡移动原理,氧化钙与水反应放出大量热温度升高,使氨的溶解度减小而放出;氧化钙与水反应消耗水,促使氨放出;氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;③中试管口应略向下倾斜;④在氨水中存在平衡:NH3+H2O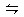 NH3·H2O
NH3·H2O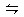 NH4++OH-,加热使温度升高,使氨的溶解度减小而放出。故正确的选项为D项。
NH4++OH-,加热使温度升高,使氨的溶解度减小而放出。故正确的选项为D项。
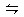 NH3·H2O
NH3·H2O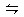 NH4++OH-,依据化学平衡移动原理,氧化钙与水反应放出大量热温度升高,使氨的溶解度减小而放出;氧化钙与水反应消耗水,促使氨放出;氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;③中试管口应略向下倾斜;④在氨水中存在平衡:NH3+H2O
NH4++OH-,依据化学平衡移动原理,氧化钙与水反应放出大量热温度升高,使氨的溶解度减小而放出;氧化钙与水反应消耗水,促使氨放出;氢氧化钙电离出的OH-增大了氨水中OH-浓度,促使氨水电离平衡左移,导致氨气放出;③中试管口应略向下倾斜;④在氨水中存在平衡:NH3+H2O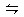 NH3·H2O
NH3·H2O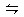 NH4++OH-,加热使温度升高,使氨的溶解度减小而放出。故正确的选项为D项。
NH4++OH-,加热使温度升高,使氨的溶解度减小而放出。故正确的选项为D项。
练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目