题目内容
【题目】漂白粉的主要成分是次氯酸钙和氯化钙。请回答下列问题:
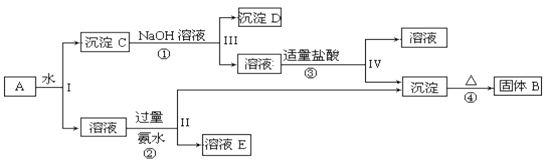
(1)漂白粉长期露置在空气中会变质,写出漂白粉变质过程中涉及的化学方程式(若涉及氧化还原反应,请标注电子转移情况):____________________________。
(2)某化学小组将完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,共收集到标准状况下448mL气体,则该漂白粉中所含有效成份的质量为_____________(假设漂白粉中的其它成份不与硝酸反应)。
【答案】Ca(ClO)2+H2O+CO2=CaCO3+2HclO; 2.86 g
2.86 g
【解析】
(1)漂白粉长期露置在空气中与水、二氧化碳反应生成HClO,HClO光照分解而变质;
(2)漂白粉中所含有效成份是次氯酸钙,完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,生成二氧化碳,根据Ca(ClO)2~CO2计算;
(1)置露在空气中会变质,发生漂白粉与二氧化碳、水的反应及次氯酸分解反应,反应分别为①Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO、② ,
,
故答案为:Ca(ClO)2+CO2+H2O=CaCO3↓+2HClO;
(2)漂白粉中所含有效成份是次氯酸钙,完全变质后的漂白粉溶于水,向其中加入足量稀硝酸,生成二氧化碳,
根据Ca(ClO)2~CaCO3~CO2,
143g 22.4L
M[Ca(ClO)2] 448mL×10-3L/mL
即:m[Ca(ClO)2]=143g/mol×(0.448L÷22.4L/mol)=2.86g,
故答案为:2.86g。

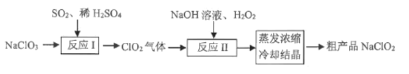
【题目】 高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如下图所示。回答下列问题:
相关金属离子[c0(Mn+)=0.1 mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和________________;写出“溶浸”中二氧化锰与硫化锰反应的化学方程式_______。
(2)“氧化”中添加适量的MnO2的作用是将________________________。
(3)“调pH”除铁和铝,溶液的pH范围应调节为_______~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是______________。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是______
(6)写出“沉锰”的离子方程式_____________________________________。
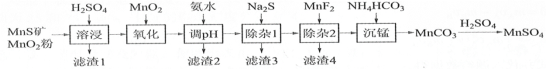
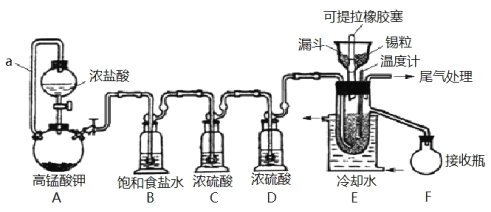
【题目】实验室可用溢流法连续制备无水四氯化锡(SnCl4)。SnCl4易挥发,极易发生水解,Cl2极易溶于SnCl4。制备原理与实验装置图如图:
Sn(s)+2Cl2(g)=SnCl4(l) ΔH=–511kJmol-1
可能用到的有关数据如下:
物质 | Sn | SnCl4 | CuCl2 |
熔点/℃ | 232 | -33 | 620 |
沸点/℃ | 2260 | 114 | 993 |
制备过程中,锡粒逐渐被消耗,需提拉橡胶塞及时向反应器中补加锡粒。当SnCl4液面升至侧口高度时,液态产物经侧管流入接收瓶。回答下列问题:
(1)a的作用是___。
(2)A中反应的化学方程式是___。
(3)B的作用是___。
(4)E中冷却水的作用是___。
(5)尾气处理时,可选用的装置是___(填序号)。
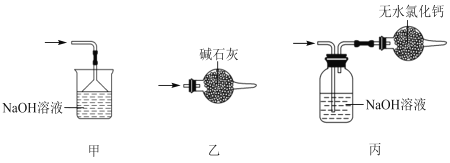
(6)锡粒中含铜杂质致 E 中产生 CuCl2,但不影响 F 中产品的纯度,原因是___。
(7)SnCl4粗品中含有Cl2,精制时加入少许锡屑后蒸馏可得纯净的SnCl4。蒸馏过程中不需要用到的仪器有___(填序号)
A.分液漏斗 B.温度计 C.吸滤瓶 D.冷凝管 E.蒸馏烧瓶