题目内容
【题目】常温下![]() 稀氨水和
稀氨水和![]() 稀盐酸等体积混合,下列判断一定正确的是
稀盐酸等体积混合,下列判断一定正确的是
A.若![]() ,则
,则![]() B.若
B.若![]() ,则
,则![]()
C.若![]() ,则
,则![]() D.若
D.若![]() ,则
,则![]()
【答案】D
【解析】
A.如果a=b,等浓度等体积的氨水和盐酸恰好反应生成氯化铵,氯化铵是强酸弱碱盐,其水溶液呈酸性即c(OH-)<c(H+),根据电荷守恒知c(NH4+)<c(Cl-),故A错误;
B.如果a>b,等体积混合时,氨水的物质的量大于盐酸,溶液可能呈中性也可能呈碱性,当溶液呈中性时,c(NH4+)=c(Cl-),当溶液呈碱性时,c(NH4+)>c(Cl-),故B错误;
C.如果a>b,等体积混合时,氨水的物质的量大于盐酸,溶液可能呈中性也可能呈碱性,当溶液呈中性时,c(OH-)=c(H+),当溶液呈碱性时,c(OH-)>c(H+),故C错误;
D.如果a<b,等体积混合时,溶液中的溶质是盐酸和氯化铵,溶液呈酸性,则c(OH-)<c(H+),故D正确;
故选:D。

【题目】纪录片《我在故宫修文物》展示了专家精湛的技艺和对传统文化的热爱与坚守,也让人体会到化学方法在文物保护中的巨大作用。
Ⅰ.某博物馆修复出土铁器的过程如下:
(1)检测锈蚀物的成分。
锈蚀物主要成分的化学式 | |||
Fe3O4 | Fe2O3·H2O | FeO(OH) | FeOCl |
FeOCl中铁元素的化合价为_______。
(2)化学修复方法:脱氯、还原,形成Fe3O4保护层。(已知:Cl-会加快铁的腐蚀)
修复过程:将铁器浸没在盛有0.5 mol·L-1 Na2SO3、0.5 mol·L-1 NaOH溶液的容器中,缓慢加热至60~90℃,一段时间后取出器物,用NaOH溶液洗涤至无Cl-。
①脱氯反应:FeOCl + OH- = FeO(OH) + Cl-。离子反应是向着离子浓度减小的方向进行的,则相同温度下,FeOCl与FeO(OH)的溶解度:s(FeOCl)______s[FeO(OH)](填>、<或=)。
②还原反应:Na2SO3还原FeO(OH)形成Fe3O4。配平化学方程式:
___Na2SO3 + ___FeO(OH) = ___Na2SO4 + ___Fe3O4 + ___H2O
③检验Cl-是否洗涤干净的方法是_______________。
Ⅱ.若要配制500mL 0.5mol·L-1的NaOH溶液用于洗涤器物,回答下列问题:
(3)配制时,应用天平称取NaOH的质量为___________(精确到小数点后两位)。
(4)某操作步骤如图所示:
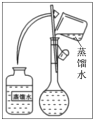
该操作应放在如图所示的____________(填序号)操作之间。
①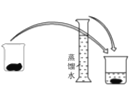 ②
②![]() ③
③![]() ④
④![]() ⑤
⑤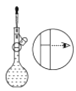 ⑥
⑥![]()
(5)下列说法错误的是_____________(填标号)。
A.称量NaOH固体的时间不宜过长
B.待烧杯中溶液冷却至室温才进行转移
C.定容时,仰视容量瓶刻度线会使配制的NaOH溶液浓度偏高
D.容量瓶可存放配好的NaOH溶液