题目内容
13.NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 1.6g甲烷含有的电子数为NA | |
| B. | 1 L0.1 mol/L NaHCO3溶液中含有的HCO3- 数目为0.1 NA | |
| C. | 1 L PH=1的硫酸溶液中含有的H+ 数为0.2 NA | |
| D. | 标准状况下,2.24 LCO和CO2混合气体中含有的氧原子数为0.15NA |
分析 A、求出甲烷的物质的量,然后根据甲烷为10电子微粒来分析;
B、HCO3-是弱酸根,在溶液中会水解;
C、pH=1说明氢离子的浓度为c(H+)=0.1mol/L,所以n(H+)=0.1mol/L×1L=0.1mol;
D、依据n=$\frac{V}{22.4}$计算标准状况气体物质的量结合极值方法分析.
解答 解:A、甲烷分子中含有10个电子,0.1 mol甲烷含有的电子数为NA,故A正确;
B、碳酸钠溶液中碳酸根离子水解减小,1 L 0.1 mol/L Na2CO3溶液中含有的CO3数目小于0.1 NA,故B错误;
C、硫酸和水中都电离出氢离子,1 L pH=1的硫酸溶液中含有的H+数大于0.2 NA,故C错误;
D、依据n=$\frac{V}{22.4}$计算标准状况气体物质的量=0.1mol,结合极值方法分析,2.24 L CO和CO2混合气体中含有的氧原子数在0.1-0.2之间,不一定是0.15NA,故D错误;
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的运用以及物质的状态和结构是解题关键,难度不大.

练习册系列答案
相关题目
3.已知金刚石的燃烧热为395kJ/mol,下表是部分化学键的键能数据.下列选项中正确的是( )
| 化学键 | C-C | O=O | C=O |
| 键能(kJ/mol) | 348 | 498 | x |
| A. | x=794.5 | |
| B. | x=1142.5 | |
| C. | 1mol金刚石的能量一定比1mol CO2能量高 | |
| D. | 金刚石燃烧的热化学方程式为 2C(s)+O2(g)=2CO(g)△H=-790 kJ/mol |
4.下列除杂操作可行的是( )
| A. | 通过浓硫酸除去HCl中的H2O | |
| B. | 通过灼热的镁粉除去N2中的O2 | |
| C. | 制二氧化氮时,用水或NaOH溶液吸收尾气 | |
| D. | 制氯气时,用饱和NaHCO3溶液和浓硫酸净化气体 |
1.化学服务于生产、生活,下列有关说法正确的是( )
| A. | 改燃煤为燃气,可以减少二氧化硫等有害气体的排放,是治理“雾霾”的措施之一 | |
| B. | 石英雕刻工艺是利用了浓硫酸的强腐蚀性 | |
| C. | 光分解水制氢气、植物秸秆制沼气、高粱制乙醇涉及到生物质能的利用 | |
| D. | 硬铝、碳素钢都是合金材料,合成纤维、光导纤维都是有机高分子化合物 |
8.常温下,下列溶液中各微粒的物质的量浓度关系正确的是( )
| A. | 0.1 mol/L pH为4的NaHB溶液中:c(HB-)>c(H2B)>c(B2-) | |
| B. | 相同条件下,pH=5的①NH4Cl溶液、②CH3COOH溶液、③稀盐酸三种溶液中由水电离出的c(H+):①>②>③ | |
| C. | 0.2mol/L的NaHCO3溶液与0.3 mol/L的Ba(OH)2溶液等体积混合,所得溶液中:c(OH-)>c(Ba2+)>c(Na+)>c(H+) | |
| D. | 等物质的量浓度的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3)+c(CO32-) |
18.下列物质所含粒子数为0.1NA(NA为阿伏加德罗常数的值)的是( )
| A. | 0.1 mo1 Na2O2所含的阴离子 | |
| B. | 1 L0.1 mol•L-1氨水中的NH${\;}_{4}^{+}$ | |
| C. | 12.5mL 16 mo1•L-1的浓硫酸能溶解的Cu | |
| D. | 4.6g N02气体所含的分子 |
5.关于下列各实验装置的叙述中,不正确的是( )
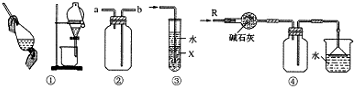

| A. | 装置①可用于分离苯和水的化合物 | |
| B. | 装置②可用于排气法收集H2、CO2、Cl2、NO、NO2等气体 | |
| C. | 装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| D. | 装置④可用于干燥、收集NH3,并吸收多余的NH3 |
2.解释下列事实的方程式正确的是( )
| A. | 加热可增强纯碱溶液去污能力:CO32-+2H2O?H2CO3+2OH- | |
| B. | 用醋酸溶液除水垢中的CaCO3:CaCO3+2H+=Ca2++H2O+CO2↑ | |
| C. | 向煤中加入石灰石可减少煤燃烧时SO2的排放:2CaCO3+O2+2SO2$\frac{\underline{\;\;△\;\;}}{\;}$2CO2+2CaSO4 | |
| D. | 碳酸氢钠溶液与少量澄清石灰水混合出现白色沉淀:CO32-+Ca2+=CaCO3↓ |
1.下列属于原子晶体的是( )
| A. | 干冰 | B. | 石英 | C. | 食盐 | D. | 冰 |