题目内容
19.下列物质属于纯净物的是( )| A. | 高锰酸钾完全分解后的残留物 | B. | 洁净的食盐水 | ||
| C. | 冰、水混合物 | D. | 含氮30%的硝酸铵(NH4NO3) |
分析 纯净物是指只有一种物质组成的物质,解答这类题目,主要是判断这种物质是由几种物质组成的,而不是判断元素的种类.
解答 解:A、高锰酸钾完全分解后的残留物为锰酸钾、二氧化锰,为混合物,故A错误;
B、洁净的食盐水是氯化钠的水溶液,属于混合物,故B错误;
C、冰和水时同种物质,属于纯净物,故C正确;
D、硝酸铵含氮量=$\frac{2N}{N{H}_{4}N{O}_{3}}$×100%=35%,含氮30%的硝酸铵(NH4NO3)不纯属于混合物,故D错误;
故选C.
点评 本题考查了物质分类方法,解答这类题目的关键是分析正确这种物质是由几种物质组成的.只有一种物质就是纯净物,含有两种或两种以上物质就是混合物,题目较简单.

练习册系列答案
相关题目
12.在相同温度下,下列化学反应速率最慢的是( )
| A. | 10mL 0.1mol/L Na2S2O3中加入10mL0.1mol/L H2SO4 | |
| B. | 5mL 0.1mol/L Na2S2O3中加入5 mL0.1mol/L H2SO4 | |
| C. | 5mL 0.1mol/L Na2S2O3中加入10mL0.05mol/L H2SO4 | |
| D. | 10mL 0.05mol/L Na2S2O3中加入10mL0.1mol/L H2SO4 |
7.下列有关碱金属铷(Rb)的叙述中,不正确的是( )
| A. | Rb2CO3易溶、易电离 | |
| B. | Rb位于周期表第五周期第ⅠA族 | |
| C. | 在钠、钾、铷三种单质中,铷的熔点最高 | |
| D. | 氢氧化铷和盐酸反应的离子方程式是OH-+H+═H2O |
14.在实验室里用铁屑、氧化铜、稀硫酸为原料制备铜,有下列两种途径:若用这两种方法制得的铜质量相等,则下列有关说法符合实际情况的是( )
(1)Fe$\stackrel{H_{2}SO_{4}}{→}$H2$\stackrel{CuO}{→}$Cu
(2)CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu.
(1)Fe$\stackrel{H_{2}SO_{4}}{→}$H2$\stackrel{CuO}{→}$Cu
(2)CuO$\stackrel{H_{2}SO_{4}}{→}$CuSO4$\stackrel{Fe}{→}$Cu.
| A. | 消耗氧化铜的质量不同 | B. | 消耗铁的质量相同 | ||
| C. | 消耗硫酸的质量相同 | D. | 生成硫酸亚铁的质量不同 |
11.NO2蒸气易形成N2O4:2NO2(g)?N2O4(g)(正反应为放热反应),现欲较准确测定NO2的相对分子质量,应采用的反应条件是( )
| A. | 高温、低压 | B. | 低温、高压 | C. | 低温、低压 | D. | 高温、高压 |
8.下列说法中正确的是( )
| A. | 2mol水的摩尔质量是1mol 水的摩尔质量的2倍 | |
| B. | 阿伏伽德罗常数就是6.02×1023 | |
| C. | 6.02×1023 mol-1叫做阿伏伽德罗常数 | |
| D. | 科学上规定含6.02×1023个粒子的任何粒子集合体计量为1mol |
9.高温下,硫酸亚铁发生如下反应:2FeSO4$\frac{\underline{\;高温\;}}{\;}$Fe2O3+SO2↑+SO3↑.若将生成的气体通入氯化钡溶液中,得到的沉淀物是( )
| A. | BaSO4 | B. | BaS | C. | BaSO3 | D. | BaSO3和BaSO4 |
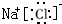 ,用电子式表示水的形成过程
,用电子式表示水的形成过程