题目内容
10.海洋面积占地球总面积的70.8%.海洋中含有丰富的资源,海水中的钠盐、镁盐等都是重要的化工原料,从海水中提取铀、重水对一个国家来说具有战略意义.(1)写出镁元素在周期表中的位置:第三周期第ⅡA族
(2)氯化钠的电子式
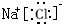 ,用电子式表示水的形成过程
,用电子式表示水的形成过程
(3)写出重水中的氢元素的核素符号:21H.
分析 地球的表面积是51000万平方千米,其中海洋的面积36100万平方千米,据此计算,
(1)镁是12号元素,核外有三个电子层,最外层电子数是2,据此判断;
(2)氯化钠是离子化合物,根据离子化合物电子式书写方法书写电子式,水是共价化合物,水分子中有氢原子和氧原子,据此写水的形成过程;
(3)重水中的氢元素有一个质子和一个中子,其质量数为2,据此写核素的符号.
解答 解:地球的表面积是51000万平方千米,其中海洋的面积36100万平方千米,海洋面积占地球总面积的70.8%,
故答案为:70.8%;
(1)镁是12号元素,核外有三个电子层,最外层电子数是2,所以镁位于周期表中第三周期第ⅡA族,
故答案为:第三周期第ⅡA族;
(2)氯化钠是离子化合物,其电子式为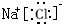 ,水是共价化合物,用电子式表示水的形成过程为
,水是共价化合物,用电子式表示水的形成过程为 ,
,
故答案为: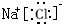 ;
; ;
;
(3)重水中的氢元素有一个质子和一个中子,其质量数为2,所以重水中的氢元素的核素符号为21H,故答案为:21H.
点评 本题考查了元素周期表、电子式、核素的书写等化学用语,题目难度不大,注重基础的考查.

练习册系列答案
 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目
3.在电解水制H2和O2时,为了增强导电性,需加入一些电解质,下列物质可选用( )
| A. | CuSO4 | B. | HC1 | C. | NaCl | D. | NaOH |
18.下列家庭小实验不能制得溶液的是( )
| A. | 食盐+水 | B. | 泥土+水 | C. | 植物油+汽油 | D. | 蔗糖+水 |
5.普通干电池两极材料是锌和石墨棒,两极间为MnO2、NH4Cl、ZnCl2糊状物,下列说法错误的是( )
| A. | 干电池中锌作负极,石墨棒作正极 | |
| B. | 负极发生还原反应:Zn-2e-═Zn2+ | |
| C. | MnO2的作用是把正极附近生成的氢气氧化成水,避免氢气泡出现 | |
| D. | 干电池工作时,由化学能转变为电能 |
15.下列离子方程式中,不正确的是( )
| A. | 稀硫酸滴在铁片上:Fe+2H+=Fe2++H2↑ | |
| B. | 钠与水的反应:2Na+2H2O=2Na++2OH-+H2↑ | |
| C. | 硫酸铜溶液与氢氧化钠溶液混合:Cu2++2OH-=Cu(OH)2↓ | |
| D. | 铜丝与硝酸银溶液反应:Ag ++Cu=Ag+Cu2+ |
2.已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如表,下列叙述正确的是( )
| 酸 | 电离平衡常数 |
| 醋酸 | Ki=1.75×10-5 |
| 次氯酸 | Ki=2.98×10-8 |
| 碳酸 | Ki1=4.30×10-7Ki2=5.61×10-11 |
| 亚硫酸 | Ki1=1.54×10-2 Ki2=1.02×10-7 |
| A. | 将0.1 mol•L-1的醋酸加水不断稀释,c(OH-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离子方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等物质的量浓度的CH3COONa、NaClO、Na2CO3和Na2SO3 四种溶液中,碱性最强的是Na2CO3 |
19.下列物质属于纯净物的是( )
| A. | 高锰酸钾完全分解后的残留物 | B. | 洁净的食盐水 | ||
| C. | 冰、水混合物 | D. | 含氮30%的硝酸铵(NH4NO3) |
20.下列各组混合物中,不能通过分液的方法进行分离的是( )
| A. | 酒精和水 | B. | 植物油和水 | C. | 汽油和水 | D. | 四氯化碳和水 |