题目内容
【题目】固体化合物 X 由 3 种元素组成。某学习小组进行了如下实验:
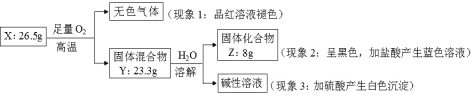
请回答:
(1)由现象 1 得出化合物 X 含有____元素(填元素符号),X 的化学式_____。
(2)固体混合物 Y 的成分_____(填化学式)。
(3)实验室常将氨气(NH3)通过红热的黑色固体化合物 Z 制备氮气,该反应的化学方程式是___,当有28克氮气生成时转移的电子的物质的量为______mol。
【答案】S BaCuS2 BaO和CuO 2NH3+3CuO3=Cu+N2↑+3H2O 6
【解析】
根据现象1可知,无色气体为SO2,向黑色固体化合物Z中加入盐酸,溶液呈蓝色,说明固体Z为CuO,向碱性溶液中加硫酸会产生白色沉淀,说明该溶液中含有Ba2+,由此可知,固体混合物Y中含有BaO,据此解答本题。
(1)根据上述分析可知,X中含有S元素,固体化合物Z的物质的量为:![]() =0.1mol,固体混合物中BaO的质量为23.3g-8g=15.3g,BaO的物质的量为:
=0.1mol,固体混合物中BaO的质量为23.3g-8g=15.3g,BaO的物质的量为:![]() =0.1mol,因此固体X中S元素的物质的量为:
=0.1mol,因此固体X中S元素的物质的量为:![]() =0.2mol,N(Cu):N(Ba):N(S)=1:1:2,故X的化学式为:BaCuS2,
=0.2mol,N(Cu):N(Ba):N(S)=1:1:2,故X的化学式为:BaCuS2,
故答案为:S;BaCuS2;
(2)由上述分析可知,Y的主要成分为:CuO和BaO,
故答案为:CuO和BaO;
(3)氨气与氧化铜在高温条件下反应,生成铜、氮气、水,其化学反应方程式为:![]() ,
,
反应![]() 中N元素由-3价变为0价,每生成1molN2转移6mol电子,故当有28克氮气即1mol生成时转移的电子的物质的量为6mol。
中N元素由-3价变为0价,每生成1molN2转移6mol电子,故当有28克氮气即1mol生成时转移的电子的物质的量为6mol。
故答案为:![]() ;6mol。
;6mol。

【题目】苯甲醛(微溶于水、易溶于有机溶剂,密度约等于水的密度)在碱性条件下发生歧化反应可以制备苯甲醇(在水中溶解度不大、易溶于有机溶剂,密度约等于水的密度)和苯甲酸。反应原理如下:2C6H5CHO+NaOH→C6H5CH2OH+C6H5COONa、C6H5COONa+HC1→C6H5COOH+NaC1
有关物质物理性质如表:
苯甲醛 | 苯甲醇 | 苯甲酸 | 苯 | |
沸点/℃ | 178 | 205 | 249 | 80 |
熔点/℃ | 26 | -15 | 12 | 5.5 |
苯甲酸在水中的溶解度 | ||
17℃ | 25℃ | 100℃ |
0.21g | 0.34g | 5.9g |
实验流程如图:

(1)第①步需连续加热1小时(如图1),其中加热和固定装置未画出。仪器A的名称为____,若将仪器B改为仪器C,效果不如B,说明原因____。

(2)操作②的实验名称为____。
(3)操作③用沸水浴加热蒸馏,再进行操作④(如图2),收集___℃的馏分。图2中有一处明显错误,正确的应改为____。
(4)抽滤时(如图3)烧杯中苯甲酸晶体转入布氏漏斗时,杯壁上还粘有少量晶体,用___冲洗杯壁上残留的晶体,抽滤完成后用____洗涤晶体。
(5)用电子天平准确称取0.2440g苯甲酸样品于锥形瓶中,加100mL蒸馏水溶解(必要时可以加热),再用0.1000 mol·L-1的标准NaOH溶液滴定,共消耗NaOH溶液19.20mL,滴定选用的指示剂为___,苯甲酸样品的纯度为____%(保留4位有效数字)。
【题目】下列实验中,实验现象及结论都正确且两者具有因果关系的是
实验 | 现象 | 结论 | |
A | 向Ba(NO3)2溶液中通入二氧化硫气体 | 有白色沉淀生成 | SO2与Ba(NO3)2反应得到BaSO3 |
B | 向FeI2的溶液中滴加少量的氯水 | 溶液颜色变深 | Cl2与Fe2+反应生成Fe3+ |
C | 向蔗糖溶液中加几滴稀硫酸,水浴加热5min后,再加新制Cu(OH)2后加热 | 无砖红色沉淀生成 | 蔗糖没有水解 |
D | 向含有酚酞的Na2CO3溶液中加入少量BaCl2固体 | 溶液红色变浅 | 证明Na2CO3溶液中存在水解平衡 |
A. A B. B C. C D. D