题目内容
20.要得到含溶质0.2mol的溶液,需取0.05mol/L的氢氧化钡溶液4000mL.分析 根据溶液体积V=$\frac{n}{c}$计算出含有0.2mol氢氧化钡时需要0.05mol/L的氢氧化钡溶液的体积.
解答 解:要得到含溶质0.2mol的溶液,需取0.05mol/L的氢氧化钡溶液为:V=$\frac{n}{c}$=$\frac{0.2mol}{0.05mol/L}$=4L=4000mL,
故答案为:4000.
点评 本题考查了物质的量浓度的计算,题目难度不大,明确物质的量浓度的概念及表达式为解答关键,试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
相关题目
10.粗略测定草木灰中碳酸钾的含量并检验钾元素的存在,需经过称量、溶解、过滤、蒸发、焰色反应等操作.下列图示对应的操作不规范的是( )
| A. |  称量 | B. | 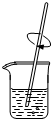 溶解 | C. |  蒸发 | D. | 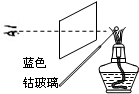 焰色反应 |
11.下列化学反应符合“电解质(Ⅰ)+电解质(Ⅱ)═电解质(Ⅲ)+电解质(Ⅳ)”的是( )
| A. | Zn+H2SO4═ZnSO4+H2↑ | B. | CaCO3+2HNO3═Ca(NO3)2+CO2↑+H2O | ||
| C. | CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O | D. | BaCl2+Na2SO4═2NaCl+BaSO4↓ |
8.设NA为阿伏加德罗常数的数值,则下列叙述不正确的是( )
| A. | 1 mol/L MgCl2溶液中含Cl-数为2NA | |
| B. | 标准状况下,2.24 L 18O2中所含中子的数目是2NA | |
| C. | 1 mol Al3+含有核外电子数为10NA | |
| D. | 常温常压下,16 g CH4中含有的原子总数为5NA |
5.有关钴和铁化合物的性质见下表
用含钴废料(含少量铁)可制备氯化钴:Co+2HCl═CoCl2+H2↑.工艺流程如下:
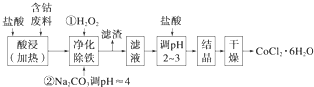
试回答:
(1)“净化除铁”中,写出加入H2O2时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)②步中用Na2CO3调pH≈4的原因是碳酸钠可与盐酸反应,降低溶液的酸性,增大pH,使铁离子沉淀完全.
(3)“滤液”中所含主要溶质的化学式是CoCl2、NaCl、HCl.
(4)为防止CoCl2•6H2O脱水,“干燥”时可采用的方法或操作是减压烘干晶体表面的水分,或常温下晾干,或常温下鼓风吹干,或低于100度小心烘干等.
| 分子式 | 溶度积Ksp | 沉淀完全时的pH | 氯化钴晶体的性质 |
| Co(OH)2 | 5.9×10-15 | 9.4 | CoCl2•6H2O呈红色,常温下稳定.110~120℃时脱水变成蓝色无水氯化钴 |
| Fe(OH)2 | 1.6×10-14 | 9.6 | |
| Fe(OH)3 | 1.1×10-36 | 3.7 |

试回答:
(1)“净化除铁”中,写出加入H2O2时反应的离子方程式2Fe2++H2O2+2H+=2Fe3++2H2O.
(2)②步中用Na2CO3调pH≈4的原因是碳酸钠可与盐酸反应,降低溶液的酸性,增大pH,使铁离子沉淀完全.
(3)“滤液”中所含主要溶质的化学式是CoCl2、NaCl、HCl.
(4)为防止CoCl2•6H2O脱水,“干燥”时可采用的方法或操作是减压烘干晶体表面的水分,或常温下晾干,或常温下鼓风吹干,或低于100度小心烘干等.
9.下列有关实验的操作、原理和现象,正确的是( )
| A. | 亚硝酸钠不稳定,常温下即会分解,可用作食品添加剂 | |
| B. | 纸层析实验中,滤纸作为惰性支持物,展开剂作为流动相 | |
| C. | 牙膏中的安息香酸钠、氟化钠等溶于水,水解使溶液显酸性 | |
| D. | 欲分离硝酸钾和氯化钠的混合物(物质的量比为1:1),先将样品溶解,然后加热至表面出现晶膜后冷却,过滤得硝酸钾晶体;将母液加热至大量晶体析出后,用余热蒸干,得氯化钠晶体 |
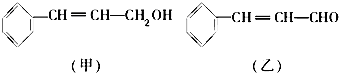
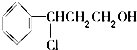 $\stackrel{O_{2}/Cu}{→}$Y$→_{Ⅱ}^{一定条件}$乙,其中反应Ⅰ的反应类型为加成反应,反应Ⅱ的化学方程式为
$\stackrel{O_{2}/Cu}{→}$Y$→_{Ⅱ}^{一定条件}$乙,其中反应Ⅰ的反应类型为加成反应,反应Ⅱ的化学方程式为 (注明反应条件).
(注明反应条件).