题目内容
8.设NA为阿伏加德罗常数的数值,则下列叙述不正确的是( )| A. | 1 mol/L MgCl2溶液中含Cl-数为2NA | |
| B. | 标准状况下,2.24 L 18O2中所含中子的数目是2NA | |
| C. | 1 mol Al3+含有核外电子数为10NA | |
| D. | 常温常压下,16 g CH4中含有的原子总数为5NA |
分析 A、溶液体积不明确;
B、求出氧气的物质的量,然后根据1mol18O2中含20mol中子来分析;
C、Al3+的核外有10个电子;
D、求出甲烷的物质的量,然后根据1mol甲烷中含5mol原子来分析.
解答 解:A、溶液体积不明确,故溶液中的氯离子的个数不能计算,故A错误;
B、标况下,2.24L氧气的物质的量为0.1mol,而1mol18O2中含20mol中子,故0.1mol此氧气中含2mol中子即2NA个,故B正确;
C、Al3+的核外有10个电子,故1mol铝离子中含10mol电子即10NA个,故C正确;
D、16g甲烷的物质的量为1mol,而1mol甲烷中含5mol原子即5NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.下列各组物质中,含原子数最多的是( )
| A. | 0.4 mol NH3 | B. | 4℃时5.4 mL水(水的密度为1g/cm3) | ||
| C. | 10 g氖气 | D. | 6.02×1023个硫酸分子 |
13.下列叙述正确的是( )
| A. | 一个分子中含有几个氢原子就是几元酸 | |
| B. | 分子数为NA的CO、C2H4混合气体质量为28g,标准状况下的体积约为22.4 L | |
| C. | 所含原子数相等的CO与CO2的密度之比为7:11 | |
| D. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% |
17.下列分子式只能表示一种物质的是( )
| A. | C4H10 | B. | CF2Cl2 | C. | C2H6O | D. | C2H4Br2 |
18.关于元素周期表的下列说法正确的是( )
| A. | 元素周期表有7个主族,7个副族,1个0族,1个第Ⅷ族,共16个纵行 | |
| B. | 除0族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数 | |
| C. | 周期表中的过渡元素全部为金属元素 | |
| D. | 若原子序数为n的原子在第ⅡA族,则原子序数为n+1的原子一定在第ⅢA族 |
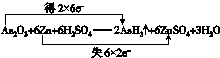 .
.
