题目内容
15.下列离子方程式书写正确的是( )| A. | 碳酸氢钠的水解反应:HCO3-+OH-?CO32-+H2O | |
| B. | 向澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | Cl2通入热的KOH溶液中制取KClO3:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
分析 A.碳酸氢根离子水解反应生成碳酸和氢氧根离子;
B.澄清石灰水中,氢氧化钙应拆成离子形式;
C.Cl2通入热的KOH溶液发生歧化反应生成氯酸钾和氯化钾、水;
D.苯酚钠溶液中通入少量CO2反应生成苯酚和碳酸氢钠.
解答 解:A.碳酸氢钠的水解反应,离子方程式:HCO3-+OH-?H2CO3+OH-,故A错误;
B.向澄清石灰水中加入盐酸,离子方程式:OH-+H+═H2O,故B错误;
C.Cl2通入热的KOH溶液中制取KClO3,离子方程式:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O,故C正确;
D.苯酚钠溶液中通入少量CO2,离子方程式:CO2+H2O+C6H5O-→C6H5OH+HCO3-,故D错误;
故选:C.
点评 本题考查了离子方程式的书写,明确反应实质是解题关键,注意苯酚酸性弱于碳酸,题目难度不大.

练习册系列答案
 备战中考寒假系列答案
备战中考寒假系列答案
相关题目
5.大气污染物NOx、SO2和可吸入颗粒物(PM2.5)等会危害人体健康,影响动植物生长因此应加强对其检测和治理.
(1)NOx可导致的环境问题有ab(选填编号).
a.酸雨 b.臭氧层受损
(2)为减少SO2的排放,可用于吸收SO2的物质是b(选填编号).
a.CaCl2溶液 b.Ca(OH)2溶液
(3)为降低NOx的排放,在汽车尾气系统中装置催化转化器,可将NOx还原成N2排出.写出NO被CO还原的化学方程式:2XCO+2N0X$\frac{\underline{\;催化剂\;}}{\;}$2XCO2+N2.
(4)某研究小组对PM2.5进行监测时,取其样本用蒸馏水处理制成待测试样,测得有关数据如表:
据此可判断试样中c(H+)=8×10-5mol/L.
(1)NOx可导致的环境问题有ab(选填编号).
a.酸雨 b.臭氧层受损
(2)为减少SO2的排放,可用于吸收SO2的物质是b(选填编号).
a.CaCl2溶液 b.Ca(OH)2溶液
(3)为降低NOx的排放,在汽车尾气系统中装置催化转化器,可将NOx还原成N2排出.写出NO被CO还原的化学方程式:2XCO+2N0X$\frac{\underline{\;催化剂\;}}{\;}$2XCO2+N2.
(4)某研究小组对PM2.5进行监测时,取其样本用蒸馏水处理制成待测试样,测得有关数据如表:
| 离子 | H+ | Na+ | NH4+ | NO3- | SO42- |
| 浓度(mol/L) | 1×10-5 | 2×10-5 | 3×10-5 | 4×10-5 |
3.甲学生对Cl2与FeCl2和KSCN混合溶液的反应进行实验探究.
(1)B中反应的离子方程式是Cl2+2OH-═Cl-+ClO-+H2O.
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为 .
.
①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
| 操 作 | 现 象 |
通入氯气至过量 | I.A中溶液变红 II.稍后,溶液由红色变为黄色 |
(2)A中溶液变红的原因是Fe2+被Cl2氧化生成Fe3+,Fe3+与SCN-反应生成红色的硫氰化钾,所以溶液变红.
(3)为了探究现象II的原因,甲同学进行如下实验.
①取A中黄色溶液于试管中,加入NaOH溶液,有红褐色沉淀生成,则溶液中一定存在Fe3+.
②取A中黄色溶液于试管中,加入过量的KSCN溶液,最终得到红色溶液.甲同学的实验证明产生现象II的原因是SCN-与Cl2发生了反应.
(4)甲同学猜想SCN-可能被Cl2氧化了,他又进行了如下研究.
资料显示:SCN-的电子式为
 .
.①甲同学认为SCN-中碳元素没有被氧化,理由是SCN-中的碳元素是最高价态+4价.
②取A中黄色溶液于试管中,加入用盐酸酸化的BaCl2溶液,产生白色沉淀,由此证明SCN-中被氧化的元素是硫元素.
③通过实验证明了SCN-中氮元素转化为NO3-,他的实验方案是取足量铜粉于试管中,加入A中黄色溶液和一定量的稀盐酸,加热,观察到试管上方有红棕色气体生成,证明A中存在,SCN-中氮元素被氧化成.
④若SCN-与Cl2反应生成1mol CO2,则转移电子的物质的量是16mol.
10.铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等.
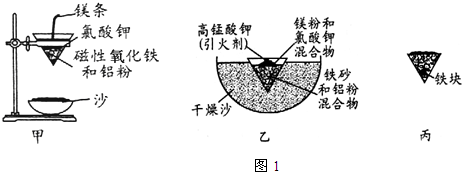
(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图1甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称),所发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
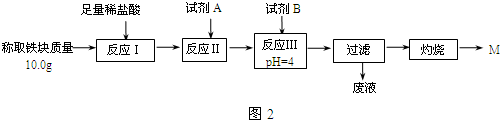
(3)为克服图1甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图2所示.
几种氢氧化物开始沉淀和完全沉淀的pH如表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”),原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.

(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图1甲)进行铝热反应,现象很壮观.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色.出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是熔融的铁被空气中氧气氧化.
(2)若证明上述所得“铁块”中含有金属铝,可选择氢氧化钠溶液(填试剂名称),所发生反应的离子方程式为2Al+2OH-+2H2O=2AlO2-+3H2↑.
(3)为克服图1甲的缺陷改用图乙装置进行铝热反应.取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图2所示.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”的纯度是84%.如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会偏小(填“偏大”“偏小”或“无影响”),原因是Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小.
20.室温下,下列有关两种溶液的说法不正确的是( )
| 序号 | ① | ② |
| pH | 12 | 12 |
| 溶液 | 氨水 | 氢氧化钠溶液 |
| A. | ①②两溶液中c(OH-)相等 | |
| B. | ①②两溶液分别加水稀释10倍,稀释后溶液的pH:①>② | |
| C. | ①溶液的物质的量浓度为0.01mol•L-1 | |
| D. | 等体积的①②两溶液分别与0.01 mol•L-1的盐酸完全中和,消耗盐酸的体积:①>② |
7.核电荷数为16的元素和核电荷数为4的原子相比较,前者的下列数据是后者的4倍的是( )
| A. | 原子半径 | B. | 最外层电子数 | C. | 电子层数 | D. | 次外层电子数 |
4.X+、Y2+、Z3+、W2-均为第三周期元索的简单离子,其中不影响水的电离平衡的微粒是( )
| A. | X+ | B. | Y2+ | C. | Z3+ | D. | W2- |
5.下列溶液均处于25℃,有关叙述正确的是( )
| A. | 某物质的水溶液PH<7,则该物质一定是酸或强酸弱碱盐 | |
| B. | pH=4.5的番茄汁中c(H+)是pH=6.5的牛奶中c(H+)的100倍 | |
| C. | 稀释醋酸溶液,溶液中所有离子的浓度均降低 | |
| D. | pH=5.6的CH3COOH与CH3COONa混合溶液中,c(Na+)>c(CH3COO-) |
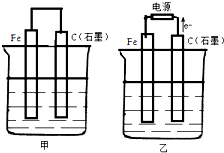 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.