题目内容
6.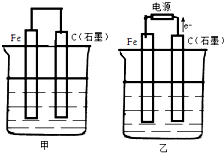 如图甲、乙是电化学实验装置.
如图甲、乙是电化学实验装置.(1)若甲、乙两烧杯中均盛有NaCl溶液,则:
①甲中石墨棒上的电极反应式为2H2O+O2+4e-═4OH-;
②乙中总反应的离子方程式为2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;
③将湿润的淀粉KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2.若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为5Cl2+I2+6H2O═10HCl+2HIO3.
(2)若甲乙两烧杯中均盛有足量CuSO4溶液,则:
①甲中铁棒上的电极反应式为Fe-2e-═Fe2+;
②如果起始时乙中盛有200mLpH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入的物质是CuO(或CuCO3)(写化学式),其质量为0.8(或1.24) g.
分析 (1)①甲为原电池装置,铁作负极,则石墨作正极,正极上氧气得电子;
②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电;
③Cl2氧化了生成的I2,Cl元素的化合价降低,由电子守恒及Cl2和I2的物质的量之比为5:1来判断反应后I元素的化合价,以此来书写化学反应;
(2)①甲为原电池装置,铁作负极,铁失电子;
②根据电解硫酸铜的化学反应及元素守恒来判断加入的物质使溶液恢复到电解前的状态,再由溶液的pH的变化计算加入物质的质量.
解答 解:(1)①甲为原电池装置,石墨棒上氧气得电子发生还原反应,反应为2H2O+O2+4e-═4OH-,
故答案为:2H2O+O2+4e-═4OH-;
②乙为电解装置,由电子流向可知石墨为阳极,阳极上氯离子放电,阴极上氢离子放电,
则电解反应为2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-,
故答案为:2Cl-+2H2O $\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑+2OH-;
③Cl2氧化了生成的I2,Cl元素的化合价降低,生成盐酸,反应中Cl2和I2的物质的量之比为5:1,设I元素的化合价为x,则5×2×1=1×2×x,解得x=+5,则生成碘酸,
所以发生的化学反应为5Cl2+I2+6H2O═10HCl+2HIO3,故答案为:5Cl2+I2+6H2O═10HCl+2HIO3;
(2)①甲为原电池装置,铁作负极,负极反应为Fe-2e-═Fe2+,故答案为:Fe-2e-═Fe2+;
②由2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+2H2SO4,要使溶液恢复原状态,可加入CuO(或CuCO3),一段时间后溶液的pH变为1,则c(H+)=0.1mol/L-10-5mol/L=0.1mol/L,
n(H+)=0.2L×0.1mol/L=0.02mol,则由电解反应可知析出的Cu的物质的量为0.01mol,由Cu原子守恒可知,
m(CuO)=0.01mol×80g/mol=0.8g,或m(CuCO3)=0.01mol×124g/mol=1.24g,
故答案为:CuO(或CuCO3);0.8(或1.24).
点评 本题考查原电池与电解池的工作原理,明确电极反应及利用电子守恒、元素守恒等计算是解答本题的关键,难度不大.

| A. | 离子化合物中一定不含共价键,共价化合物中一定不含离子键 | |
| B. | 分子间作用力越大,分子的热稳定性就越大 | |
| C. | 可能存在不含任何化学键的晶体 | |
| D. | 酸性氧化物形成的晶体一定分子晶体 |
| Q | R | ||
| T | W |
 .
.(2)元素的原子的得电子能力为:Q<W(填“>”或“<”).
(3)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质,其中一种是具有漂白性的气体,反应的化学方程式为:S+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$3SO2↑+2H2O.
| X | Y | ||
| Z | W |
| A. | 气态氢化物的热稳定性:X<Y | |
| B. | 最高价氧化物对应水化物的酸性:W>Z>X | |
| C. | X、Y、Z元素均存在同素异形体 | |
| D. | W的单质具有漂白性,能使干燥的有色布条褪色 |
| A. | 碳酸氢钠的水解反应:HCO3-+OH-?CO32-+H2O | |
| B. | 向澄清石灰水中加入盐酸:Ca(OH)2+2H+═Ca2++2H2O | |
| C. | Cl2通入热的KOH溶液中制取KClO3:3Cl2+6OH-$\frac{\underline{\;\;△\;\;}}{\;}$ClO3-+5Cl-+3H2O | |
| D. | 苯酚钠溶液中通入少量CO2:CO2+H2O+2C6H5O-→2C6H5OH+CO32- |
| A. | 还原→取代→加成→消去 | B. | 氧化→加成→取代→消去 | ||
| C. | 消去→加聚→取代→还原 | D. | 还原→消去→加成→取代 |

