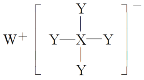题目内容
【题目】铁氰化钾(化学式为K3[Fe(CN)6])主要应用于制药、电镀、造纸、钢铁生产等工业。其煅烧分解生成KCN、FeC2、N2、(CN)2等物质。
(1)铁元素在周期表中的位置为_________,基态Fe3+ 核外电子排布式为_________。
(2)在[Fe(CN)6]3- 中不存在的化学键有_________。
A. 离子键 B.金属键 C.氢键 D. 共价键
(3)已知(CN)2性质类似Cl2:
(CN)2+2KOH=KCN+KCNO+H2O KCN+HCl=HCN+KCl HC≡CH+HCN→H2C=CH-C≡N
①KCNO中各元素原子的第一电离能由小到大排序为________。
②丙烯腈(H2C=CH-C≡N)分子中碳原子轨道杂化类型是_______;分子中σ键和π键数目之比为_______。
(4)C22-和N2互为等电子体,CaC2晶体的晶胞结构与NaCl晶体的相似(如图甲所示),但CaC2晶体中哑铃形的C22-使晶胞沿一个方向拉长,晶体中每个Ca2+周围距离最近的C22-数目为_______。
(5)金属Fe能与CO形成Fe(CO)5,该化合物熔点为-20℃,沸点为103℃,则其固体属于_______晶体。
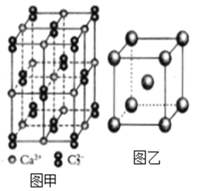
(6)图乙是Fe单质的晶胞模型。已知晶体密度为dg·cm-3,铁原子的半径为_________nm(用含有d、NA的代数式表示)。
【答案】第四周期 Ⅷ族 [Ar]3d5或1s22s22p63s23p63d5 AB K<C<O<N sp sp2 2:1 4 分子 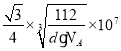
【解析】
(1)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为[Ar]3d64s2,据此确定其在周期表的位置;基态Fe失去4s上2个电子和3d轨道上1个电子即为Fe3+;
(2)根据化学键的类型和特点解答,注意氢键是分子间作用力,不是化学键;
(3)①KCNO由K、C.N、O四种元素组成,K为金属、容易失去电子,第一电离能最小,C、N、O位于第二周期,但N的p轨道是半充满状态、能量最低;
②丙烯腈(H2C=CHC≡N)分子中碳原子VSEPR构型有两种形式:平面三角形和直线形,杂化方式也有sp、sp2两种形式,其中C=C含有1个σ键和1个π键、C≡N含有1个σ键和2个π键,CH都是σ键,确定分子中σ键和π键数目,再求出比值;
(4)1个Ca2+周围距离最近且等距离的C22应位于同一平面,注意使晶胞沿一个方向拉长的特点;
(5)Fe(CO)5的熔点、沸点均不高,类似于分子晶体的特点;
(6)Fe单质的晶胞模型为体心立方堆积,晶胞的原子均摊数为8×![]() +1=2,晶胞的质量为
+1=2,晶胞的质量为![]() g,晶胞体积V=
g,晶胞体积V=![]() cm3、边长a=
cm3、边长a=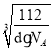 cm,根据Fe原子半径r与晶胞边长a关系求出r。
cm,根据Fe原子半径r与晶胞边长a关系求出r。
(1)Fe的原子序数是26,根据构造原理知Fe的核外电子排布式为[Ar]3d64s2,位于第四周期Ⅷ族据;基态Fe失去4s上2个电子和3d轨道上1个电子即为Fe3+,所以基态Fe3+核外电子排布式为) [Ar]3d5或1s22s22p63s23p63d5故答案为:第四周期Ⅷ族,[Ar]3d5或[Ar]3d5或1s22s22p63s23p63d5;
(2)[Fe(CN)6]3是阴离子,是配合物的内界,含有配位键和极性共价键,金属键存在于金属晶体中,氢键是分子间作用力,不是化学键,故选AB;故答案为:AB;
(3)①KCNO中K为金属、容易失去电子,第一电离能最小,C、N、O位于第二周期,但N的p轨道是半充满状态、能量最低,所以第一电离能大于O,C的非金属性小于O,第一电离能小于O,所以第一电离能由小到大排序为K<C<O<N;故答案为:K<C<O<N;
②丙烯腈(H2C=CHC≡N)分子中碳原子VSEPR构型有两种形式:平面三角形和直线形,杂化方式也有sp、sp2两种形式,其中C=C含有1个σ键和1个π键、C≡N含有1个σ键和2个π键,CH都是σ键,所以分子中σ键和π键数目分别为6、3,σ键和π键数目之比为6:3=2:1;故答案为:sp、sp2;2:1;
(4)依据晶胞示意图可以看出,晶胞的一个平面的长与宽不相等,再由图中体心可知1个Ca2+周围距离最近的C22不是6个,而是4个,故答案为:4;
(5)根据Fe(CO)5的熔点、沸点均不高的特点,可推知Fe(CO)5为分子晶体;故答案为:分子;
(6)Fe单质的晶胞模型为体心立方堆积,晶胞的原子均摊数为8×![]() +1=2,晶胞的质量为
+1=2,晶胞的质量为![]() g,晶胞体积V=
g,晶胞体积V=![]() cm3、边长a=
cm3、边长a=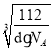 cm,Fe原子半径r与晶胞边长a关系为4r=
cm,Fe原子半径r与晶胞边长a关系为4r=![]() a,所以r=
a,所以r=![]() a=
a=![]()
![]()
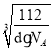 cm=
cm=![]()
![]()
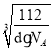 ×107nm;故答案为:
×107nm;故答案为:![]()
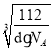 ×107。
×107。

【题目】新能源汽车的核心部 件是锂离子电池,磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。
[方法一]高温固相法是磷酸亚铁锂生产的主要方法。通常以亚铁盐(如FeC2O42H2O)磷酸盐和锂盐为原料,充分混匀后,在惰性气氛的保护气中先经过较低温预分解,再经过高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4 =2NH3↑+3CO2↑+ + +
(1)完成上述化学方程式______。
(2)理论上,反应中每转移0.15mol电子,会生成 ______gLiFePO4。
[方法二]以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:
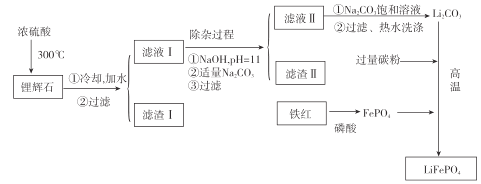
已知:2LiAl(SiO3)2+H2SO4(浓)![]() Li2SO4 + Al2O34SiO2H2O↓
Li2SO4 + Al2O34SiO2H2O↓
温度/℃ | 20 | 40 | 60 | 80 |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.5 |
(1)向滤液II中加入饱和Na2CO3溶液,过滤后 ,用“热水洗涤”的原因是_____。
(2)滤渣II的主要成分是_______(填化学式)。
(3)写出在高温下生成磷酸亚铁锂的化学方程式:_____________。
(4)工业上,将 Li2CO3粗品制备成高纯 Li2CO3 的部分工艺如下:
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解,阳极的电极反应式是____________。
②电解后向产品LiOH 溶液中加入过量 NH4 HCO3并加热,过滤、烘干得高纯 Li2CO3。 请写出生成Li2CO3的化学方程式:___________。
【题目】下表为元素周期表的一部分,请参照元素①-⑧在表中的位置,回答下列问题:
族 周期 | IA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | |||||
3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||
(1)①形成的阴离子的结构示意图为___。如果③原子中含8个中子,则其原子符号为___。
(2)③、④、⑤、⑥简单离子半径由小到大的顺序为___。(填离子符号)
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:___。
(4)设计实验证明⑧的非金属性比⑦强,用化学方程式表示___。
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
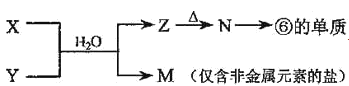
(a)X溶液与Y溶液反应的离子方程式为___。
(b)N→⑥的单质的化学方程式为___。
【题目】Ⅰ.已知X元素和碳元素同主族,位于周期表中的第1个长周期,是最早使用的半导体材料。短周期元素Y原子的最外层电子数比内层电子总数少3,它们形成的化合物的分子式是XY4。
(1)元素Y原子核外电子有___________种不同运动状态。
(2)X元素原子的价电子的轨道表示式为______________________________.
(3)若X、Y两元素电负性分别为2.1和3.0,则XY4中X与Y之间的化学键为________(填“共价键”或“离子键”)。
(4)该化合物分子为________(填“极性”或“非极性”)分子。
Ⅱ. 已知X、Y为第3周期的两种元素,其原子的部分电离能(kJ·mol-1)如下表所示:
I1 | I2 | I3 | I4 | |
X | 496 | 4562 | 6912 | 9540 |
Y | 577 | 1817 | 2754 | 11578 |
(5)Y单质与X的最高价氧化物对应的水化物反应的化学方程式为:_________。
(6)X晶体采用的堆积方式与金属钾相同,X晶体采用下列________(填字母)堆积方式。
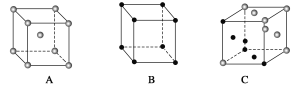
(7)NaCl、KCl、MgO、CaO晶体结构相似,其中三种晶体的晶格能数据如下表:
晶体 | NaCl | KCl | CaO |
晶格能/kJ·mol-1 | 786 | 715 | 3401 |
四种晶体NaCl、KCl、MgO、CaO熔点由高到低的顺序是____________________。