题目内容
【题目】设 NA为阿伏加德罗常数的值。下列有关叙述正确的是
A.常温下,1 L 0.5 mol/L CH3COONH4 溶液的 pH=7,则溶液中 CH3COO-与 NH4+的数目均为 0.5NA
B.10 g 质量分数为 46%的乙醇溶液中含有氢原子的数目为 0.6 NA
C.16g 氨基(-NH2)中含有的电子数为 7 NA
D.在密闭容器中将 2 mol SO2 和 1 mol O2 混合反应后,体系中的原子数为 8 NA
【答案】D
【解析】
A.由于醋酸根和铵根均会发生水解,所以溶液中这两种离子的数目一定小于0.5NA,A项错误;
B.该溶液中乙醇的质量为4.6g,根据公式计算可知:![]() ;该溶液中的水的质量为5.4g,根据公式计算可知:
;该溶液中的水的质量为5.4g,根据公式计算可知:![]() ;所以溶液中的H原子数目为1.2NA,B项错误;
;所以溶液中的H原子数目为1.2NA,B项错误;
C.1个氨基中含有9个电子,16g氨基即1mol,所以含有电子数为9NA,C项错误;
D.密闭容器中发生的虽然是可逆反应,但原子总数守恒,所以为8 NA,D项正确;
答案选D。

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案【题目】新能源汽车的核心部 件是锂离子电池,磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。
[方法一]高温固相法是磷酸亚铁锂生产的主要方法。通常以亚铁盐(如FeC2O42H2O)磷酸盐和锂盐为原料,充分混匀后,在惰性气氛的保护气中先经过较低温预分解,再经过高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4 =2NH3↑+3CO2↑+ + +
(1)完成上述化学方程式______。
(2)理论上,反应中每转移0.15mol电子,会生成 ______gLiFePO4。
[方法二]以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:
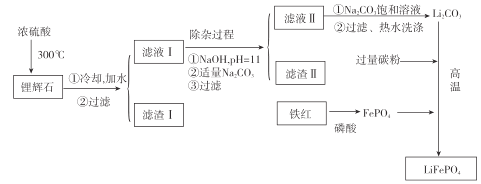
已知:2LiAl(SiO3)2+H2SO4(浓)![]() Li2SO4 + Al2O34SiO2H2O↓
Li2SO4 + Al2O34SiO2H2O↓
温度/℃ | 20 | 40 | 60 | 80 |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.5 |
(1)向滤液II中加入饱和Na2CO3溶液,过滤后 ,用“热水洗涤”的原因是_____。
(2)滤渣II的主要成分是_______(填化学式)。
(3)写出在高温下生成磷酸亚铁锂的化学方程式:_____________。
(4)工业上,将 Li2CO3粗品制备成高纯 Li2CO3 的部分工艺如下:
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解,阳极的电极反应式是____________。
②电解后向产品LiOH 溶液中加入过量 NH4 HCO3并加热,过滤、烘干得高纯 Li2CO3。 请写出生成Li2CO3的化学方程式:___________。