题目内容
【题目】下列各表述与示意图不一致的是
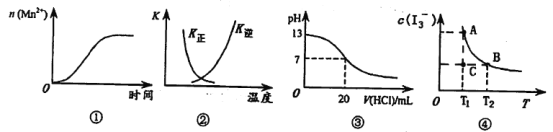
A.图①表示5 mL 0.01 mol·L-1 KMnO4酸性溶液与过量的0.1 mol·L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化
B.图②中曲线表示反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0正、逆反应的平衡常数K随温度的变化
2SO3(g) △H<0正、逆反应的平衡常数K随温度的变化
C.图③表示25℃时,用0.1 mol·L-1盐酸滴定20 mL 0.1 mol·L-1 NaOH溶液,溶液的pH随加入酸体积的变化
D.I2在KI溶液中存在I2(aq)+I-(aq)![]() I3-(aq)的平衡,c(I3-)与温度T的关系如图④,若反应进行到状态C时,一定有V(正)>V(逆)
I3-(aq)的平衡,c(I3-)与温度T的关系如图④,若反应进行到状态C时,一定有V(正)>V(逆)
【答案】C
【解析】
KMnO4酸性溶液与H2C2O4溶液混合:![]() ;升高温度,平衡向吸热方向移动;当加入盐酸20 mL时,pH发生骤变;曲线AB表示平衡状态,在状态C时,在温度T1下, c(I3-)过低,未达到平衡,所以反应需正向进行以达到平衡。
;升高温度,平衡向吸热方向移动;当加入盐酸20 mL时,pH发生骤变;曲线AB表示平衡状态,在状态C时,在温度T1下, c(I3-)过低,未达到平衡,所以反应需正向进行以达到平衡。
A.酸性KMnO4与H2C2O4混合![]() ,随着反应的进行,不断有Mn2+生成,最终趋于稳定,故A正确;
,随着反应的进行,不断有Mn2+生成,最终趋于稳定,故A正确;
B.反应2SO2(g)+O2(g)![]() 2SO3(g) △H<0,升高温度,平衡向吸热方向移动,逆向移动,故升高温度,K逆增大,K正减小,B正确;
2SO3(g) △H<0,升高温度,平衡向吸热方向移动,逆向移动,故升高温度,K逆增大,K正减小,B正确;
C.强酸滴定强碱,当加入盐酸20 mL时,pH发生骤变,故图像不符,C错误;
D.曲线AB表示平衡状态,在状态C时,在温度T1下, c(I3-)过低,未达到平衡,所以反应需正向进行以达到平衡,故在状态C时,一定有V(正)>V(逆),故D正确;
答案选C。

 名校课堂系列答案
名校课堂系列答案【题目】下列各组物质,不能按如图(“→”表示反应一步完成)关系转化的是

选 项 | a | b | c |
A | Al2O3 | NaAlO2 | Al(OH)3 |
B | Al | Al(OH)3 | Al2O3 |
C | AlCl3 | Al(OH)3 | NaAlO2 |
D | MgCl2 | Mg(OH)2 | MgO |
A. AB. BC. CD. D