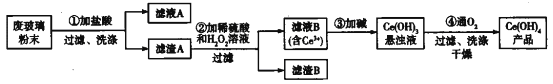
题目内容
【题目】下列叙述中不正确的是
A.NH3分子与H+结合的过程中,N原子的杂化类型未发生改变
B.某晶体固态不导电,熔融状态能导电,可以较充分说明该晶体是离子晶体
C.区分晶体和非晶体最可靠的科学方法是对固体进行X-射线衍射实验
D.气态SO3和SO2中心原子的孤电子对数目相等
【答案】D
【解析】
NH3分子与H+结合生成NH4+;离子晶体是电解质,晶体不能导电,但水溶液或熔融状态下能导电;构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X射线衍射图谱反映出来;计算中心原子的孤电子对数目: ![]() (中心原子价电子数-中心原子结合的原子数
(中心原子价电子数-中心原子结合的原子数![]() 中心原子结合的原子提供的单电子数)。
中心原子结合的原子提供的单电子数)。
A.NH3分子与H+结合生成NH4+,反应前后N原子的杂化类型均为sp3,符合题意及,故A正确;
B.离子晶体是电解质,晶体不能导电,但水溶液或熔融状态下能导电,因此,某晶体固态不导电,熔融状态能导电,可以较充分说明该晶体是离子晶体,故B正确;
C.构成晶体的粒子在微观空间里呈现周期性的有序排列,晶体的这一结构特征可以通过X射线衍射图谱反映出来。因此,区分晶体和非晶体的最可靠的科学方法是对固体进行X射线衍射实验,故C正确;
D.通过公式计算中心原子的孤电子对数,SO3:![]() 、SO2:
、SO2:![]() ,所以二者的孤电子对数目不相等;故D错误;
,所以二者的孤电子对数目不相等;故D错误;
答案选D。

练习册系列答案
 冲刺100分单元优化练考卷系列答案
冲刺100分单元优化练考卷系列答案
相关题目