题目内容
【题目】下列关于热化学反应的描述中正确的是( )
A. HCl和NaOH反应的中和热ΔH=﹣57.3 kJ·mol-1![]() ,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
,则H2SO4和Ca(OH)2反应的中和热是ΔH=2×(﹣57.3)kJ·mol-1
B. 1 mol甲烷燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热
C. 需要加热才能发生的反应一定是吸热反应
D. CO(g)的燃烧热是283.0 kJ·mol-1![]() ,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
,则2CO2(g)====2CO(g)+O2(g)反应的ΔH=+566.0 kJ·mol-1
【答案】D
【解析】
试题A、中和热是指稀酸与稀碱反应生成1mol水放出的热量,中和热数值与参加反应的酸与碱物质的量无关,则H2SO4和Ba(OH)2反应的中和热ΔH=-57.3kJ/mol,A错误;B、1mol甲烷燃烧生成液态水和二氧化碳所放出的热量是甲烷的燃烧热,B错误;C、需要加热才能发生的反应不一定是吸热反应,如燃烧反应,C错误;D、CO燃烧热△H=-283.0kJ/mol,则燃烧的热化学方程式为2CO(g)+O2(g)=2CO2(g)△H=-2×283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=+2×283.0kJ/mol,D正确。答案选D。

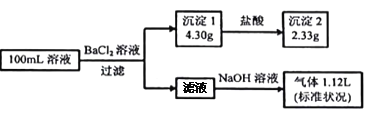
【题目】某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要流程如下:

(1)为提高含锰矿物浸出速率,可采取的措施有______________(至少写出两条)。
(2)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。设备1中发生氧化还原反应的离子方程式是______________________________________。
(3)设备2中加足量双氧水的作用是________________________。设计实验方案检验滤液2中是否存在Fe2+________________________。
(4)已知金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,加氨水调节溶液的pH等于6,滤渣2的主要成分为_____________ (填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(5)设备4中加入过量氢氧化钠溶液,用离子方程式表示发生的反应______________。
(6)保持其他条件不变,在不同温度下对含锰矿物进行酸浸,锰浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、______min。