题目内容
8.甲同学想通过下图所示装置(夹持装置已略去)进行实验,研究推断SO2与Na2O2反应的产物.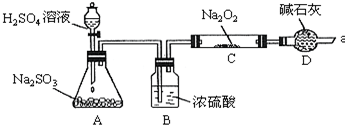
回答下列问题:
(1)装置B的作用干燥SO2气体,防止较多的水蒸气与反应.装置D的作用防止空气中的水蒸气和二氧化碳进入C装置与反应;同时吸收过量的,以免污染空气.
(2)如何检验反应中是否有O2生成:用带有余烬的木条靠近干燥管口a,观察其是否燃烧.
(3)假如已反应完全,为确定C中固体产物的成分,甲设计如下实验:

得出结论:产物是Na2SO4.该方案是否合理否(填是或否),理由是与BaCl2能形成不溶于硝酸的白色沉淀的钠盐还有可能是亚硫酸钠.
分析 A用于制备二氧化硫气体,B干燥装置,除去二氧化硫中的水蒸气,防止水与过氧化钠反应而影响实验结论,D可用于吸收二氧化硫,防止污染空气,并吸收空气中的水和二氧化碳,防止与过氧化钠反应,如能生成氧气,可用带有余烬的木条检验,假如Na2O2已反应完全,为确定C中固体产物的成分是否为Na2SO4,应先加入盐酸酸化,再加入氯化钡检验,注意不能用硝酸,防止亚硫酸钠被硝酸氧化,以此解答该题.
解答 解:(1)因生成的二氧化硫混有水蒸气,为防止较多的水蒸气与过氧化钠反应,应先用浓硫酸干燥,二氧化硫有毒,不能直接排空,二氧化硫是酸性氧化物能和碱性物质反应,所以用碱石灰吸收二氧化硫防止污染空气,且D可吸收空气中的水和二氧化碳,防止与过氧化钠反应,
故答案为:干燥二氧化硫,防止较多的水蒸气与过氧化钠反应;防止空气中的水和二氧化碳进入C装置与过氧化钠反应,同时吸收过量的二氧化硫,以免污染空气;
(2)氧气的检验方法是:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成,否则没有,
故答案为:将带火星的木条靠近管口a,若木条复燃,说明有氧气生成;
(3)产物可能为Na2SO4,亚硫酸钠和氯化钡反应生成亚硫酸钡,硝酸有强氧化性,能把亚硫酸钡氧化生成硫酸钡,干扰了亚硫酸根离子的检验,所以该方案不合理,
故答案为:Na2SO4,否; 与BaCl2能形成不溶于硝酸的白色沉淀的钠盐还有可能是亚硫酸钠.
点评 本题考查了物质的性质实验设计,为高频考点,侧重于学生的分析能力的考查,注意把握实验的原理,难度不大,会根据题中给予信息分析问题、解决问题.

练习册系列答案
相关题目
19.若1mol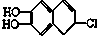 分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )
分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )
 分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )
分别与溴水、氢气和NaOH溶液完全反应,最多消耗Br2、氢气和NaOH的物质的量分别是( )| A. | 2mol、4mol、2mol | B. | 2mol、3mol、3mol | C. | 3mol、2mol、2mol | D. | 3mol、4mol、3mol |
16.以下物质间的每步转化都可以通过一步反应能实现的是( )
| A. | Al→Al2O3→Al(OH)3→Na[Al(OH)4] | B. | Fe→FeO→Fe(OH)2→Fe(OH)3 | ||
| C. | Si→SiO2→H2SiO3→Na2SiO3 | D. | Na→Na2O2→Na2CO3→NaOH |
3.在一密闭容器中充入某气态烃和足量的氧气,用电火花点燃完全燃烧后,容器内气体体积保持不变,若气体体积均在120℃和相同的压强下测定的,则该气态烃不可能是( )
| A. | CH4 | B. | C2H6 | C. | C2H4 | D. | C3H4 |
20.下列有关实验方法或描述正确的是( )
| A. | 加入稀盐酸产生无色气体,将气体通入品红溶液,品红褪色,加热后褪色,一定有SO32- | |
| B. | 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- | |
| C. | 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- | |
| D. | 加入氢氧化钠溶液并加热,产生的气体能使湿润红色石蕊试纸变蓝,一定有NH4+ |
17.根据下列短周期元素性质的数据判断,下列说法正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径∕10-10m | 0.66 | 1.36 | 1.23 | 1.10 | 0.99 | 1.54 | 0.70 | 1.24 |
| 最高价或最低价 | -2 | +2 | +1 | +5 -3 | +7 -1 | +1 | +5 -3 | +3 |
| A. | 元素④⑤形成的化合物是离子化合物 | |
| B. | 元素⑦位于第二周期第V族 | |
| C. | 元素①⑧形成的化合物具有两性 | |
| D. | 元素③的最高价氧化物对应水化物的碱性最强 |
18.下列原子的电子排布图中,正确的是( )
| A. | 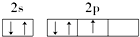 | B. |  | ||
| C. | 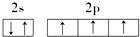 | D. | 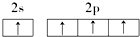 |