题目内容
6.下列分子中所有原子都满足最外层8电子结构的是( )①SF6 ②PCl5 ③PCl3 ④CS2 ⑤NO2 ⑥N2.
| A. | ①②④⑤ | B. | ②③⑤⑥ | C. | ③④⑥ | D. | ①③⑤ |
分析 分子中原子的最外层电子数可以根据每种元素原子的最外层电子数与化合价的绝对值之和来判断.
解答 解:①、六氟化硫中,S原子的原子核外最外层电子数为6,其在分子中的化合价为+6价,在分子中的原子最外层电子数为12,故错误;
②、PCl5 中,P原子的原子核外最外层电子数为5,其在分子中的化合价为+5价,在分子中的原子最外层电子数为10,故错误;
③、三氯化磷中,P原子的原子核外最外层电子数为5,其在分子中的化合价为+3价,在分子中的原子最外层电子数为8,故正确;
④CS2中,C原子的原子核外最外层电子数为4,其在分子中的化合价为+4价,在分子中的原子最外层电子数为8,故正确;
⑤NO2中,N原子的原子核外最外层电子数为5,其在分子中的化合价为+4价,在分子中的原子最外层电子数为9,故错误;
⑥N2中氮与氮形成三对共用电子对,分子中所有原子都满足最外层8电子结构,故正确;
故选C.
点评 本题考查原子的结构,本题中注意判断是否满足8电子结构的方法,注意利用化合价与最外层电子数来分析即可解答,明确所有原子都满足最外层8电子结构是解答的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.常温下,足量的铝,分别与下列酸反应时,放出H2最多的是( )
| A. | 600mL 18.4mol/L H2SO4 | B. | 100mL 1mol/L HCl | ||
| C. | 200mL 80% HNO3 | D. | 600mL 0.1mol/L HNO3 |
17.有一瓶K2SO3溶液,由于它可能部分被氧化,某同学进行如下实验:取少量样品溶液,滴入Ba(NO3)2溶液,产生白色沉淀,再加入足量稀硝酸,充分振荡后,仍有白色沉淀.对此实验下述结论正确的是( )
| A. | K2SO3已部分被空气中的氧气氧化 | |
| B. | 加入Ba(NO3)2溶液后,生成的沉淀中一定含有BaSO4 | |
| C. | 加硝酸后的不溶性沉淀中含有BaSO3 | |
| D. | 此实验不能确定K2SO3是否部分被氧化 |
14.实验室常利用以下反应制取少量氮气:NaNO2+NH4Cl═NaCl+N2↑+2H2O关于该反应的下列说法正确的是( )
| A. | N2既是氧化剂,又是还原剂 | |
| B. | NaNO2是氧化剂 | |
| C. | NH4Cl中的氮元素被还原 | |
| D. | 每生成1 mol N2时,转移电子的物质的量为6 mol |
11.下列说法正确的是( )
| A. | 离子化合物中可能含有共价键,但不一定含有金属元素 | |
| B. | 分子中一定含有共价键 | |
| C. | 非极性分子中一定存在非极性键 | |
| D. | 极性分子中一定不存在非极性键 |
18.1mol CH4与Cl2发生取代反应,待反应完成后测得4种取代物的物质的量相等,则消耗的Cl2为( )
| A. | 0.5mol | B. | 2mol | C. | 2.5mol | D. | 4mol |
 使用如图所示装置进行化学小实验,请填写下列空白:
使用如图所示装置进行化学小实验,请填写下列空白: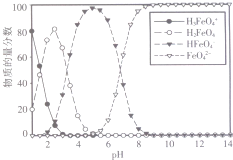 高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.
高铁酸钾(K2FeO4)是一种绿色氧化剂,在许多领域展现出广阔的应用前景.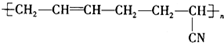 具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )
具有优良的耐油耐高温性能,合成丁腈橡胶的原料是( )