题目内容
氨气溶于水得到氨水,氯气溶于水得到氯水,下列关于新制的氨水、氯水的描述正确的是
| A.“两水”都是混合物,溶液中含有的粒子种类、数目相同 |
| B.“两水”中都存在可逆反应的化学平衡和弱电解质的电离平衡 |
| C.“两水”都有刺激性气味,都能漂白有机色素 |
| D.“两水”放置时间较久后都会因为相同的原理而变质 |
B
解析试题分析:A、含有的粒子种类、数目不同,错误;B、正确;C、氨水不能漂白,错误;D、氨水因氨气挥发而变质,氯水因Cl2+H2O=HCl+HClO,2 HClO=2HCl+O2↑,原理不同,错误。
考点:考查氨水和氯水等相关知识。

 阅读快车系列答案
阅读快车系列答案(NH4)2SO4在一定条件下发生如下分解反应:
4(NH4)2SO4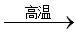 N2↑+6NH3↑+3SO2↑+SO3↑+7H2O
N2↑+6NH3↑+3SO2↑+SO3↑+7H2O
将反应后的混合气体通入一定量的氯化钡溶液中,下列说法中不正确的是( )
| A.一定没有亚硫酸钡沉淀 |
| B.一定有硫酸钡沉淀生成 |
| C.得到的沉淀是亚硫酸钡和硫酸钡的混合物 |
| D.逸出的气体是氨气和二氧化硫气体 |
在研究合成氨方法的历史上,不同的研究者曾3次获诺贝尔化学奖。合成氨大大提高了农作物的产量,同时也是制取硝酸、炸药等的原料。下列说法中正确的是
| A.N2和H2在点燃或光照条件下可合成氨气 |
| B.氨和HNO3都是电解质 |
| C.氨气遇到浓硝酸会发生反应产生大量白烟 |
| D.由NH3制HNO3的过程中,氮元素被还原 |
在8.08g铁与铜的混和物中,加入200mL 0.6mol/L的稀硝酸,充分反应后剩余金属5.44g。再向其中加入50mL 0.4mol/L的稀硫酸,充分振荡后剩余金属4.48g。若硝酸的还原产物只有NO,下列说法正确的是
| A.剩余的5.44g金属为铁 | B.剩余5.44g金属为铜 |
| C.共生成NO气体 0.03mol | D.8.08g金属中铁的质量分数为0.208 |
下列有关含氯化合物的说法正确的是
| A.HCIO是弱酸,所以NaC1O是弱电解质 |
| B.向沸水中逐滴加入少量饱和FeCl3溶液,可制得Fe(OH)3胶体 |
| C.HCl溶液和NaCl溶液均通过离子导电,所以HCl和NaCl均是离子化合物 |
| D.工业上电解NaCl溶液得到22.4LH2(标准状况),理论上需要转移阿伏加德罗常数个电子NA |
硝酸铜是制备Cu—Zn—Al系催化剂的重要原料。现有三种制取硝酸铜的实验方案可供选用:①铜与稀硝酸反应制取:3Cu + 8HNO3(稀)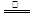 3Cu(NO3)2 + 2NO↑+ 4H2O
3Cu(NO3)2 + 2NO↑+ 4H2O
②铜与浓硝酸反应制取:Cu + 4HNO3(浓)= Cu(NO3)2 + 2NO2↑+ 2H2O
③首先将铜屑在空气中加热生成氧化铜,氧化铜与稀硝酸反应制取:2Cu + O2 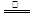 2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )
2CuO,CuO + 2HNO3 = Cu(NO3)2 + H2O 下列有关说法正确的是( )
| A.制取等量的硝酸铜,需硝酸的量②最少 |
| B.制取等量的硝酸铜,②产生的有毒气体比①少 |
| C.三种方案中,第③方案最经济环保 |
| D.三种方案的反应都可以在铁质容器中进行 |
下列对事实的解释不正确的是
| 选项 | 事实 | 解释 |
| A | 用铝罐槽车储运浓硫酸 | 浓硫酸的强氧化性使铝钝化 |
| B | 用饱和NH4Cl溶液处理过的舞台布帘可防火 | NH4Cl分解吸热,且分解产物能隔绝空气中的氧气 |
| C | 钠元素的焰色反应呈黄色 | Na2O2是一种淡黄色的固体 |
| D | SO2能使溴水褪色 | SO2具有还原性 |
【化学—选修2:化学与技术】(15分)
I、污水经过一级、二级处理后,还含有少量Cu2+、Hg2+、Pb2+等重金属离子,可加入沉淀剂使其沉淀。下列物质不能作为沉淀剂的是
| A.氨水 | B.硫化氢气体 | C.硫酸钠溶液 | D.纯碱溶液 |

回答下列问题:
(1)工业合成氨的原料是氮气和氢气。氮气是从空气中分离出来的,通常使用的两种分离方法是 , ;氢气的来源是水和碳氢化合物,写出分别采用煤和天然气为原料制取氢气的化学反应方程式 ,
;
(2) 设备A中含有电加热器、触煤和热交换器,设备A的名称 ,其中发生的化学反应方程式为 ;
(3) 设备B的名称 ,其中m和n是两个通水口,入水口是 (填“m”或“n”)。不宜从相反方向通水的原因 ;
(4) 设备C的作用 ;
(5)在原料气制备过程中混有CO对催化剂有毒害作用,欲除去原料气中的CO,可通过如下反应来实现:CO(g)+H2O(g)
 CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。
CO2 (g)+ H2 (g) , 已知1000K时该反应的平衡常数K=0.627,若要使CO的转化超过90%,则起始物中c(H2O):c(CO)不低于 。 