题目内容
1. 利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.
利用化学反应将存储在物质内部的化学能转化为电能,科学家设计出了原电池,从而为人类生产、生活提供能量.(1)甲同学认为,所有的氧化还原反应都可以设计成原电池,你是否同意否(填“是”或“否”).若不同意,请你试举一例,写出相应的化学方程式:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO
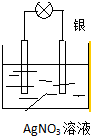
(2)乙同学依据氧化还原反应:2Ag++Cu=Cu2++2Ag设计的原电池如图所示:
①负极的材料是Cu,发生的电极反应为Cu-2e-=Cu2+;
②外电路中的电子是从Cu电极流向Ag电极.(写出电极材料的名称)
③当反应进行到一段时间后取出电极材料,测得某一电极增重了5.4g,则该原电池反应共转移了的电子数目是0.05mol
④请指出该原电池装置的一个缺点:能量利用率低,不能提供持续稳定的电流.
分析 (1)原电池的反应必须是自发的氧化还原反应;
(2)①根据电池反应式知,失电子化合价升高的金属作负极,负极发生氧化反应;
②电子从负极沿导线流向正极;
③根据电极反应式计算通过电子的物质的量;
④能量利用率低,不能提供持续稳定的电流是该原电池装置的缺点.
解答 解:(1)原电池的反应必须是自发的氧化还原反应,从理论上来讲,任何自发的氧化还原反应均可设计为原电池,非自发进行的氧化还原反应不能设计为原电池,例如:C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO,故答案为:否;C+CO2$\frac{\underline{\;高温\;}}{\;}$2CO;
(2)①由反应“2Ag++Cu═Cu2++2Ag”可知,在反应中,Cu被氧化,失电子,应为原电池的负极,反应式为Cu-2e-=Cu2+,故答案为:Cu;Cu-2e-=Cu2+;
②电子从负极Cu沿导线流向正极Ag,故答案为:Cu;Ag;
③当银电极质量增加5.4g,则n(Ag)=$\frac{5.4g}{108g/mol}$=0.05mol,根据电极反应Ag++e-=Ag,可知导线中通过的电子的物质的量为0.05mol,故答案为:0.05mol;
④能量利用率低,不能提供持续稳定的电流是该原电池装置的缺点,故答案为:能量利用率低,不能提供持续稳定的电流.
点评 本题考查了原电池设计,明确原电池原理是解本题关键,根据电池反应式中得失电子的物质选取负极材料和电解质,知道原电池中正负极的判断方法,难度不大.

练习册系列答案
相关题目
19.为了测定某未知NaOH溶液的浓度,需要0.200mol•L-1的盐酸溶液500mL.某学生用实验室中常用的36.5%(密度为1.20g•cm-3)的浓盐酸配制所需稀盐酸,并设计了以下步骤完成实验.
(1)请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序.
A.用b(从以下备选仪器中选取适当仪器将其序号填入)量(或称)取36.5%(密度为1.19g•cm-3)的浓盐酸8.3ml(填写所需体积或质量).
a.50mL量筒; b.10mL量筒; c.托盘天平.
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释.
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处.
D.等溶液恢复至室温.
E.将溶液用玻璃棒引流转入500ml容量瓶(填写所需仪器)中,再用适量蒸馏水洗涤烧杯和玻璃棒2~3次一并转入其中.
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可.
以上各实验步骤的正确排列顺序是ABDECF.
(2)准确移取20.00mL待测NaOH溶液于一洁净锥形瓶中,然后用所配标准盐酸溶液进行滴定(以酚酞为指示剂).滴定结果如下表:
根据以上数据计算出未知NaOH溶液的物质的量浓度为0.22mol•L-1(精确到0.01).
(3)下列操作或叙述正确的是BC(填写序号).
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平.
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中.
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液.
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次.
(4)下列操作或现象会导致测定结果偏高的是ACE(填写序号).
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定.
(1)请你帮助该同学完成以下各步中的内容,并将其所设计的实验步骤正确排序.
A.用b(从以下备选仪器中选取适当仪器将其序号填入)量(或称)取36.5%(密度为1.19g•cm-3)的浓盐酸8.3ml(填写所需体积或质量).
a.50mL量筒; b.10mL量筒; c.托盘天平.
B.将取好的浓盐酸在烧杯中加适量蒸馏水稀释.
C.轻轻振荡后继续加蒸馏水到液面距离仪器刻线1~2cm处.
D.等溶液恢复至室温.
E.将溶液用玻璃棒引流转入500ml容量瓶(填写所需仪器)中,再用适量蒸馏水洗涤烧杯和玻璃棒2~3次一并转入其中.
F.用胶头滴管加蒸馏水直到溶液液面恰好与刻线相切,塞好瓶塞摇匀即可.
以上各实验步骤的正确排列顺序是ABDECF.
| 实验序号 | 滴定管液面起始读数 | 滴定管液面终点读数 |
| 1 | 1.32mL | 23.36mL |
| 2 | 2.26mL | 24.22mL |
根据以上数据计算出未知NaOH溶液的物质的量浓度为0.22mol•L-1(精确到0.01).
(3)下列操作或叙述正确的是BC(填写序号).
A.滴定过程中,眼睛注视滴定管内溶液并使视线与液面的凹面水平.
B.滴定过程中由于摇动锥形瓶使少许溶液溅起沾在瓶内壁,为使测定结果正确,可用少许蒸馏水将其冲入锥形瓶内的溶液中.
C.容量瓶和滴定管在使用前洗净后都要检查是否漏液.
D.向锥形瓶中移取NaOH溶液前,用少许NaOH溶液润洗锥形瓶2~3次.
(4)下列操作或现象会导致测定结果偏高的是ACE(填写序号).
A.滴定过程中不小心将一滴溶液滴在锥形瓶外;
B.滴定结束时,发现在滴定管尖嘴处有小气泡;
C.滴定结束后仰视滴定管液面读数;
D.溶液褪色立即读数,摇动锥形瓶后看到溶液红色复出;
E.酸式滴定管用蒸馏水洗净后,未用标准盐酸润洗,直接加入标准液进行滴定.
9.将铜粉放入稀H2SO4中,加热无明显现象,但加入某化合物后,发现铜粉质量逐渐减少,则该化合物不可能是( )
| A. | Fe2(SO4)3 | B. | FeSO4 | C. | KNO3 | D. | Fe3O4 |
16.某烃的一种同分异构体的一氯代物只有一种,该烃的分子式是( )
| A. | C6H14 | B. | C5H12 | C. | C4H10 | D. | C3H8 |
13.下列说法正确的是( )
| A. | 在常温常压下,11.2L N2含有的分子数为0.5NA | |
| B. | 32g O2含原子数目为2NA | |
| C. | 标准状况下,18g H2O所占的体积为22.4L | |
| D. | 在同温同压下,相同体积任何气体单质所含的原子数目相同 |
10.下列化合物中,既显酸性,又能发生加成反应、氧化反应、酯化反应和消去反应的是( )
| A. | 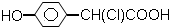 | B. | CH3CH (OH)-CH=CH-COOH | ||
| C. | CH3-CH=CH-COOH | D. | CH3CH(OH)CH2CHO |