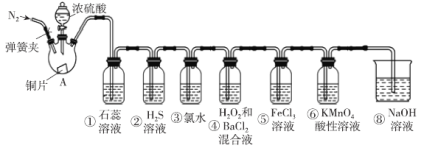
题目内容
【题目】三室式电渗析法处理含NH4NO3废水的原理如图所示,工作一段时间后,在两极区均得到副产品NH4NO3。下列叙述错误的是( )
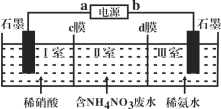
A.a极为电源负极,b极为电源正极
B.c膜是阳离子交换膜,d膜是阴离子交换膜
C.阳极电极反应式为4OH--4e-=O2↑+2H2O
D.Ⅱ室溶液的pH保持不变
【答案】D
【解析】
在直流电场的作用下,两膜中间的NH4+和NO3-可通过离子交换膜,工作一段时间后,在两极区均得到副产品NH4NO3,则NH4+向左移动,NO3-向右移动,在两极分别产生NH4NO3;在电解池中,阳离子向阴极移动,则与电源a电极连接的石墨为阴极,电极反应2H++2e-=H2↑,Ⅰ室中阳离子减少,NH4+移动到Ⅰ室与硝酸根,形成硝酸铵。a为电源负极,b为电源正极,与之相连的石墨为阳极,电极反应4OH--4e-=2H2O+O2↑,Ⅲ室中剩余较多NH4+,NO3-移动到Ⅰ室与铵根,形成硝酸铵据此分析判断。
A、分析可知a极为电源负极,b极为电源正极,故A正确;
B、工作一段时间后,在两极区均得到副产品NH4NO3,则NH4+向左移动,NO3-向右移动,在两极分别产生NH4NO3;所以c膜是阳离子交换膜,d膜是阴离子交换膜;故B正确;
C.根据分析可知阳极的电极反应式为:4OH--4e-=2H2O+O2↑,故C正确;
D.Ⅱ室中存在铵根的水解使溶液显酸性,随着铵根离子进入Ⅰ室,溶液酸性逐渐减弱,故D错误;
故答案为D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目