题目内容
【题目】某实验小组同学对电化学原理进行了一系列探究活动。
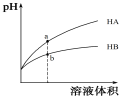
(1)如图为某实验小组设计的原电池装置,反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过_______mol电子。
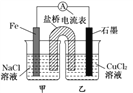
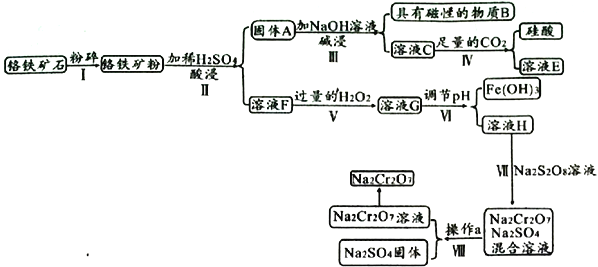
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式:_____________________,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是,“溶液中的十3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:________________________________。
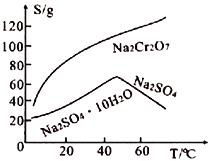
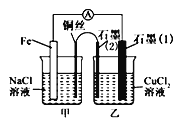
(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是_______________,电极反应为________________;乙装置中石墨(1)为_______(填“正”“负”“阴”或“阳”),乙装置中与铜丝相连石墨电极上发生的反应式为______________________。
【答案】 0.2 2H++2e-===H2↑ 2Fe2++Cl2===2Fe3++2Cl- 2Fe3++3Cl2+8H2O===2FeO![]() +6Cl-+16H+ 溶液变红 O2+2H2O+4e-===4OH- 阴 2Cl--2e-===Cl2↑
+6Cl-+16H+ 溶液变红 O2+2H2O+4e-===4OH- 阴 2Cl--2e-===Cl2↑
【解析】
(1)设计的原电池装置的自发氧化还原反应是:![]() ,设电子转移量是xmol,则
,设电子转移量是xmol,则![]() ,计算得出
,计算得出![]() ,
,
因此,本题正确答案是:0.2。;
(2)氯化铵中,铵根离子水解导致溶液显示酸性,实质是:![]()
![]()
![]() ,正极发生
,正极发生![]() ↑,用吸管吸出铁片附近溶液即
↑,用吸管吸出铁片附近溶液即![]() 的溶液,加入氯水发生
的溶液,加入氯水发生![]() ═
═![]() ,如果+3价铁被氧化为
,如果+3价铁被氧化为![]() ,发生
,发生![]() ═
═![]() ,因此,本题正确答案是:
,因此,本题正确答案是:![]() ↑;
↑;![]() ═
═![]() ;
;![]() ═
═![]() ;
;
(3)若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,铁为负极,铜为正极,正极发生![]() ═
═![]() ,呈碱性,滴加酚酞,溶液变红,则乙装置与铜相连的石墨为阳极,与铁相连的石墨为阴极,乙为电解池装置,阳极发生
,呈碱性,滴加酚酞,溶液变红,则乙装置与铜相连的石墨为阳极,与铁相连的石墨为阴极,乙为电解池装置,阳极发生![]() ═
═![]() ↑。因此,本题正确答案是:溶液变红;
↑。因此,本题正确答案是:溶液变红;![]() ═
═![]() ;阴;
;阴;![]() ═
═![]() ↑
↑
点睛:(1)根据自发氧化还原反应知识来书写,并根据两极反应结合两极质量变化进行计算;
(2)氯化铵中,铵根离子水解导致溶液显示酸性,正极生成氢气;用吸管吸出铁片附近溶液即![]() 的溶液,加入氯水发生
的溶液,加入氯水发生![]() ═
═![]() ;
;
(3)若将盐桥换成弯铜导线与石墨相连成n型,甲装置为铁的吸氧腐蚀,乙为电解池装置.

【题目】向2L密闭容器中加入1molNO和1mol活性炭,发生反应:2NO(g)+C(s) ![]() N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
N2(g)+CO2(g) △H = -213.5kJ/mol,达到平衡的数据如下:
温度/℃ | n(活性炭)/mol | n(CO2)/mol |
T1 | 0.70 | —— |
T2 | —— | 0.25 |
下列说法不正确的是( )
A. 上述信息可推知:T1<T2
B. T1℃时,该反应的平衡常数K=9/16
C. T1℃时,若开始时反应物的用量均减小一半,平衡后NO的转化率减小
D. T2℃时,若反应达平衡后再缩小容器的体积。c(N2)/c(NO)不变