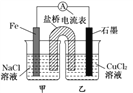
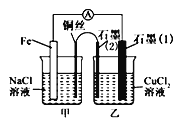
题目内容
【题目】把铝粉和Fe3O4粉末配成铝热剂并分成两等份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应,第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是
A. 3∶8 B. 8∶3
C. 3∶4 D. 4∶3
【答案】C
【解析】
把Al和Fe3O4粉末配成铝热剂,分成两等份,第一份在高温下恰好完全反应,然后将生成物与足量的盐酸充分反应,发生的反应为:8Al+3Fe3O4![]() 4Al2O3+9Fe、Fe+2HCl=FeCl2+H2↑,即8Al~9Fe~9H2,第二份直接加入足量的氢氧化钠溶液使之充分反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,即8Al~12H2。两份铝热剂中铝的量相同,则前后两种情况下生成气体的物质的量之比为3︰4,答案C正确。
4Al2O3+9Fe、Fe+2HCl=FeCl2+H2↑,即8Al~9Fe~9H2,第二份直接加入足量的氢氧化钠溶液使之充分反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,即8Al~12H2。两份铝热剂中铝的量相同,则前后两种情况下生成气体的物质的量之比为3︰4,答案C正确。
故选C。

【题目】某蓄电池的反为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是_______(填选项字母)。放电时生成Fe(OH)2的质量为18g,则外电路中转移的电子数是_________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的____(填“正”或“负”)极相连。
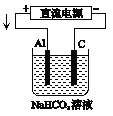
(3)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用两为个相关的方程式表示)①_________________②__________________________。
(4)精炼铜时,粗铜应与直流电源的______(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是____________________________________。乙同学认为应将方案中的pH调节到8,你认为此观点________(填“正确”或“不正确”),理由是___________________________。