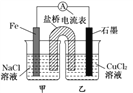
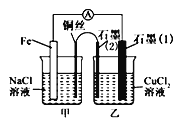
题目内容
【题目】如图是中学化学中常用于混合物的分离和提纯的装置,请根据装置回答问题:
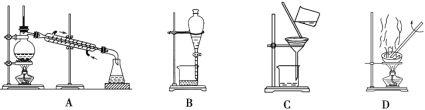
(1)从氯化钾溶液中得到氯化钾固体,选择装置________(填代表装置图的字母,下同);除去自来水中的Cl等杂质,选择装置________。
(2)从碘水中分离出I2,选择装置________,该分离方法的名称为________。
(3)装置A中①的名称是________,进水的方向是从________(填“上”或“下”)口进水。装置B在操作时为使液体顺利滴下,除打开下端活塞外,还应进行的具体操作是________________________________。
(4)为了除去KCl中的Ca2+、Mg2+、![]() 及泥沙,得到纯净的KCl,可将混合物溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序进行提纯,正确的步骤及顺序是___________。
及泥沙,得到纯净的KCl,可将混合物溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序进行提纯,正确的步骤及顺序是___________。
①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液 ⑥加过量KOH溶液 ⑦加过量K2CO3溶液
A.②⑤④①③ B.⑥⑤⑦①③ C.④①②⑤③ D.④②⑤①③
【答案】D A B 萃取分液 冷凝管 下 打开分液漏斗上口的活塞或者是活塞上的凹槽对准小孔 B
【解析】
(1) 氯化钾溶液中得到氯化钾固体可以采用蒸发结晶;除去自来水中的Cl-等杂质,可以采用蒸馏的方法;
(2) 碘易溶于有机物,可以采用萃取分液的方法进行分离;
(3) 根据蒸馏装置所用的仪器回答;冷凝管的冷却水的方向采用逆流原理冷凝效果好;保证分液漏斗内外压平衡,才能时液体顺利流出;
(4) 为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,先过滤除去泥沙,再加NaOH除去Mg2+,加过量BaCl2溶液除去SO42-,加过量Na2CO3溶液除去Ca2+及过量钡离子,过滤除去沉淀,最后加适量盐酸,以此来解答。
(1) 可以采用蒸发结晶的方法从氯化钾溶液中得到氯化钾固体,选D装置;除去自来水中的Cl-等杂质,可以采用蒸馏的方法,100℃蒸发出来的是水蒸气,选A装置;
综上所述,本题答案是:D ,A。
(2) 从碘水中分离出I2,可以加入四氯化碳萃取剂,采用萃取分液的方法,选用B装置;
综上所述,本题答案是:B,萃取分液。
(3) 装置A为蒸馏装置,①的名称是冷凝管;冷凝管的冷却水的方向是下进上出;在使用分液漏斗时,要打开分液漏斗上端活塞或使凹槽对准小孔,以保证内部液体顺利流下;
综上所述,本题答案是:冷凝管,下,打开分液漏斗上口的活塞或者是活塞上的凹槽对准小孔。
(4) 为了除去粗盐中的Ca2+、Mg2+、SO42-及泥沙,得到纯净的NaCl,先过滤除去泥沙,再加NaOH除去Mg2+,加过量BaCl2溶液除去SO42-,加过量Na2CO3溶液除去Ca2+及过量钡离子,过滤除去沉淀,最后加适量盐酸,则正确的顺序为⑥⑤⑦①③;B正确;
综上所述,本题选B。

 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案【题目】根据题目要求回答下列问题:
(1)某同学查阅资料并设计如下实验。
资料:AgSCN是白色沉淀,相同温度下,溶解度AgSCN>AgI。
操作步骤 | 现象 |
步骤1:向2 mL 0.005 mol/L AgNO3溶液中加入2 mL 0.005 mol/L KSCN溶液,静置 | 出现白色沉淀 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/L Fe(NO3)3溶液 | 溶液变为红色 |
步骤3:向步骤2的溶液中继续加入5滴3 mol/L AgNO3溶液 | 溶液浑浊、红色变浅 |
步骤4:向步骤1余下的浊液中加入5滴3 mol/L KI溶液 | 出现黄色沉淀 |
① 步骤3实验目的是_____________________________。
② 用化学平衡原理解释步骤4中的实验现象:___________________________。
(2)已知:
NH4Cl(s) = NH3(g) + HCl(g) ΔH = +163.9 kJmol-1
HCl(g) + CH3OH(g) = CH3Cl(g) + H2O(g) ΔH = -31.9 kJmol-1
①写出氯化铵和甲醇反应的热化学方程式____________________________,该反应在一定条件下能自发进行的原因是___________________________。
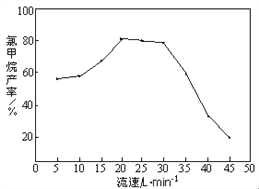
②由下图知,HCl和CH3OH的混合气体通过催化剂时的最佳流速在20 Lmin-1~30 Lmin-1之间。流速过快,会导致氯甲烷产率下降,原因是_________________________。流速过慢,会使副产物二甲醚增多,其反应为2CH3OH → CH3OCH3 + H2O,生产中常通入适量的水蒸气,该操作对制备CH3Cl的影响是___________________________。
(3)某高能锂离子电池充电时,总反应方程式为LiMn2O4=Li1-xMn2O4+xLi。则充电时阳极的电极反应方程式为______________________________________________。若电池的化学能转化为电能时的能量转化率为90%,则当消耗14 g锂时,电路中转移的电子数目为__________NA。