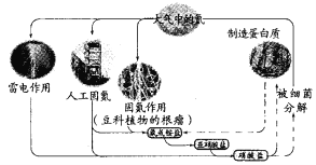
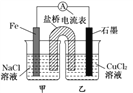
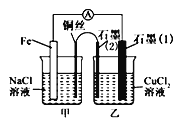
题目内容
【题目】某铬铁矿主要成分是FeO·Cr2O3,含有FeCO3、SiO2、Fe3O4等杂质,现由该铬铁矿制备强氧化剂Na2Cr2O7的流程如下:
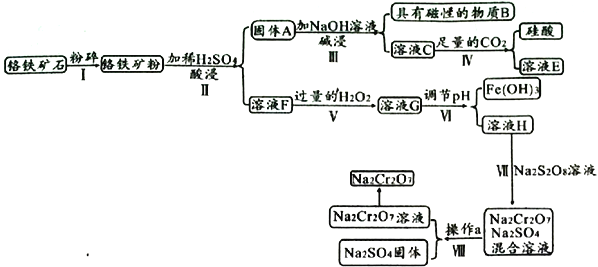
已知:常温下,Ksp[Fe(OH)3]=1.0×10-38,Ksp[Cr(OH)3]=6.3×10-30
回答下列问题:
(1)物质B为______________,溶液E为____________________。
(2)溶液G中经检测不含H2O2的可能原因是________________________________________。
(3)若步骤Ⅵ调节pH后,c(Cr3+)=6.3mol/L,则pH范围是______________(离子浓度不大于1.0×10-5mol/L即可认为沉淀完全)。
(4)步骤Ⅶ发生的离子方程式为________________________________________。
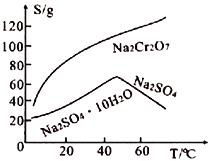
(5)Na2Cr2O7和Na2SO4的溶解度随温度变化的曲线如下图所示,步骤Ⅷ中操作a为___________、__________________。
(6)若称取mg该铬铁矿,其中FeO·Cr2O3的质量分数为70%,最终制得ng Na2Cr2O7固体,则该过程中Cr元素的转化率为____________________________。
【答案】 Fe3O4 NaHCO3 过量的H2O2,被Fe3+催化分解 3≤pH<4 7H2O+3S2O32-+2Cr3+=6SO42-+Cr2O72-+14H+ 加热浓缩 趁热过滤 ![]() ×100%
×100%
【解析】分析:注意天然Fe3O4是一种反式尖晶石结构,晶体结构为六方晶系的永久磁石(硬磁体),结构牢固,很难与酸反应。由已知铬铁矿主要成分结合流程可得,铬铁矿粉酸浸后,所得溶液F中阳离子主要为:Fe2+和Cr3+,固体A为难溶的SiO2、Fe3O4等杂质;SiO2与NaOH溶液反应生成硅酸钠,硅酸钠与足量CO2反应生成碳酸氢钠和硅酸;溶液F中的Fe2+被H2O2氧化成Fe3+,通过调节pH除去Fe3+;Cr2(SO4)3溶液(H)与Na2S2O8溶液反应得到Na2Cr2O7和Na2SO4的混合溶液,最后经过一系列操作得到固体。
详解:(1)物质B具有磁性,结合铬铁矿的成分及流程可得,B为Fe3O4;溶液C为硅酸钠溶液,因为通入足量CO2,所以生成E为NaHCO3。
(2)H2O2在催化剂作用下容易分解为水和氧气,因为溶液F中的Fe2+被H2O2氧化成Fe3+,而Fe3+可以作为H2O2分解的催化剂,所以溶液G中不含H2O2。
(3)步骤Ⅵ调节pH的目的是除去Fe3+,留下Cr3+,因为离子浓度不大于1.0×10-5mol/L即可认为沉淀完全,根据常温下,Ksp[Fe(OH)3]=1.0×10-38,Fe3+刚好沉淀完全时:c(Fe3+)c3(OH-)=Ksp[Fe(OH)3],即1.0×10-5×c3(OH-)=1.0×10-38,解得:c(OH-)=10-11,所以c(H+)=Kw/10-11=10-3,则pH=3;根据常温下,Ksp[Cr(OH)3]=6.3×10-30,调节pH后,c(Cr3+)=6.3mol/L,Cr3+刚开始沉淀时:c(Cr3+)c3(OH-)=Ksp[Cr(OH)3],即6.3×c3(OH-)=6.3×10-30,解得:c(OH-)=10-10,所以c(H+)=Kw/10-10=10-4,则pH=4,综上分析,步骤Ⅵ调节pH范围是:3≤pH<4。
(4)步骤Ⅶ中,Cr3+和S2O32-发生氧化还原反应生成Cr2O72-和SO42-,根据电子守恒、原子守恒及电荷守恒,离子方程式为:7H2O+3S2O32-+2Cr3+=6SO42-+Cr2O72-+14H+。
(5)步骤Ⅷ中,从Na2Cr2O7和Na2SO4的混合液中得到Na2SO4固体,由图可知,温度升高有利于硫酸钠结晶析出,而Na2Cr2O7的溶解度增大不会析出,所以操作a可以是:加热浓缩、趁热过滤。
(6)mg铬铁矿中Cr元素的质量为:![]() =
=![]() ,最终制得n g Na2Cr2O7中Cr元素的质量为:
,最终制得n g Na2Cr2O7中Cr元素的质量为:![]() =
=![]() ,所以Cr元素的转化率为:
,所以Cr元素的转化率为:![]() ÷()×100%=
÷()×100%=![]() ×100%。
×100%。

 阅读快车系列答案
阅读快车系列答案【题目】某蓄电池的反为NiO2+Fe+2H2O![]() Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)该蓄电池充电时,发生还原反应的物质是_______(填选项字母)。放电时生成Fe(OH)2的质量为18g,则外电路中转移的电子数是_________________。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)为防止远洋轮船的钢铁船体在海水中发生电化学腐蚀,通常在船体上镶嵌Zn块,或与该蓄电池的____(填“正”或“负”)极相连。
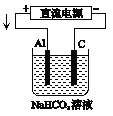
(3)以该蓄电池作电源,用如图所示的装置在实验室模拟铝制品表面“钝化”处理的过程中,发现溶液逐渐变浑浊,原因是(用两为个相关的方程式表示)①_________________②__________________________。
(4)精炼铜时,粗铜应与直流电源的______(填“正”或“负”)极相连。精炼过程中,电解质溶液中的c(Fe2+)、c(Zn2+)会逐渐增大而影响进一步电解。甲同学设计如下除杂方案:
![]()
已知:
沉淀物 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
开始沉淀时的pH | 2.3 | 7.5 | 5.6 | 6.2 |
完全沉淀时的pH | 3.9 | 9.7 | 6.4 | 8.0 |
则加入H2O2的目的是____________________________________。乙同学认为应将方案中的pH调节到8,你认为此观点________(填“正确”或“不正确”),理由是___________________________。