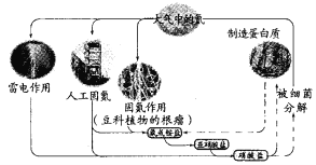
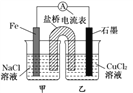
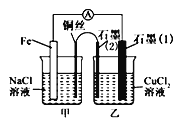
题目内容
【题目】25℃时,相同pH值的两种一元弱酸HA与HB溶液分别加水稀释,溶液pH值随溶液体积变化的曲线如图所示。
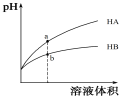
下列说法正确的是
A.同浓度的NaA与NaB溶液中,c(A-) 小于c(B-)
B.a点溶液的导电性大于b点溶液
C.a点的c(HA)大于b点的c(HB)
D.HA 的酸性强于HB
【答案】D
【解析】
试题分析:A、根据图像可知稀释相同的倍数时HA的pH变化大,这说明HA的酸性强于HB的酸性,所以同浓度的NaA与NaB溶液中,A-的水解程度小于B-离子的水解程度,则溶液中c(A-) 大于c(B-),A错误;B、a点溶液的pH大,氢离子浓度小,所以导电性弱于b点溶液,B错误;C、HA的酸性强于HB,则在pH相等的条件下HA的浓度小于HB的浓度,稀释相等倍数后a点的c(HA)小于于b点的c(HB),C错误;D、根据以上分析可知HA 的酸性强于HB,D正确,答案选D。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目