题目内容
20.如果空气中含甲烷5%~15.4%,遇明火会发生爆炸,发生最强烈爆炸时空气中甲烷所占的体积分数是9.5%.分析 甲烷与氧气的反应方程式为:CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O,当甲烷与氧气体积之比为1:2时,发生最强烈爆炸,设混合气体的体积为100L,甲烷体积为VL,消耗O2的体积为2VL,则空气体积(100-V)L,根据氧气在空气的体积分数列式计算出V,进而计算甲烷的体积分数.
解答 解:根据CH4+2O2$\stackrel{点燃}{→}$CO2+2H2O可知,当甲烷与氧气体积之比为1:2时,发生最强烈爆炸,
设混合气体的体积为100L,甲烷体积为VL,消耗O2的体积为2VL,则空气体积(100-V)L,
则(100-V)×21%=2V;解得V=9.5L,
所以发生爆炸最强烈时,甲烷在空气中所占的体积分数为:$\frac{9.5L}{100L}$×100%=9.5%,
故答案为:9.5%.
点评 本题考查混合物反应的计算、根据化学方程式计算,题目难度不大,注意根据方程式确定甲烷与氧气的体积关系,明确当甲烷与氧气体积之比为1:2时发生最强烈爆炸为解答关键.

练习册系列答案
相关题目
10.一定条件下,中学化学常见物质,甲、乙、丙、X之间存在“甲$\stackrel{x}{→}$乙$\stackrel{x}{→}$丙”的转化关系,丙不可能是( )
| A. | SO3 | B. | NO2 | C. | Si | D. | CH3COOH |
11.实验室可以用铁片与稀硫酸反应制取氢气,下列措施不能使氢气的生成速率增大的是( )
| A. | 加热 | |
| B. | 加入少量CuSO4溶液 | |
| C. | 不用稀硫酸,改用质量分数为98%的浓硫酸 | |
| D. | 不用铁片,改用铁粉 |
8.某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.
向2支盛有1mL 1mol/L的MgCl2溶液中各加入10滴2mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如表:
(1)测得实验Ⅰ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因NH4++H2O?NH3•H2O+H+.
(2)同学们猜测实验Ⅰ中沉淀溶解的原因有两种:
猜想1:氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水.
猜想2:氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水.
(3)为验证猜想,又设计了以下实验
①用醋酸铵溶液与氢氧化镁反应的原因是醋酸铵溶液呈中性,如果氢氧化镁能溶解于醋酸铵,说明是NH4+结合氢氧化镁电离出的OH-离子,导致沉淀溶解平衡移动正向移动,达到沉淀溶解.
②实验证明猜想正确的是1(填“1”或“2”).
(4)实验Ⅱ观察到沉淀不溶解.该实验的目的是做对比分析,排除实验中溶剂水使沉淀溶解的可能性.
向2支盛有1mL 1mol/L的MgCl2溶液中各加入10滴2mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4mL 2mol/L NH4Cl 溶液 | 沉淀溶解 |
| Ⅱ | 4mL蒸馏水 | 沉淀不溶解 |
(2)同学们猜测实验Ⅰ中沉淀溶解的原因有两种:
猜想1:氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水.
猜想2:氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水.
(3)为验证猜想,又设计了以下实验
| 序号 | 实验内容 | 结 果 |
| 1 | 测定醋酸铵溶液的pH | pH约为7,溶液呈中性 |
| 2 | 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 | 固体均溶解 |
②实验证明猜想正确的是1(填“1”或“2”).
(4)实验Ⅱ观察到沉淀不溶解.该实验的目的是做对比分析,排除实验中溶剂水使沉淀溶解的可能性.
15.在含有7.4g Ca(OH)2的澄清石灰水中通入amol CO2时生成5g沉淀,再通入b mol CO2共生成10g沉淀,再通入cmol CO2还剩5g沉淀,再通入dmol CO2,沉淀恰好溶解得澄清溶液,则下列叙述中正确的是( )
| A. | a:(b+c+d)=1:1.5 | B. | (a+b):(c+d)=1:1 | C. | a=b=c=d=1.12L | D. | a+b+c=d=0.2mol |
5.有关金属的腐蚀与防护叙述正确的是( )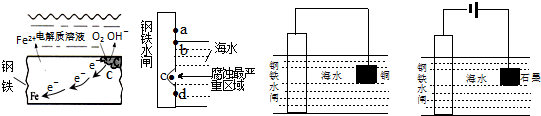

| A. | 钢铁发生吸氧腐蚀时,电子流动方向可用图甲示意图表示 | |
| B. | 钢铁水闸在发生吸氧腐蚀时,产生铁锈最多的位置在图乙d处 | |
| C. | 用牺牲阳极保护法保护钢铁水闸时,可用图丙所示装置示意 | |
| D. | 用外接电源阴极保护法保护钢铁水闸时,可用图丁所示装置示意 |
9.2012年“六•五”世界环境日中国主题为“绿色消费 你行动了吗?”,旨在强调绿色消费的理念,唤起社会公众转变消费观念和行为,节约资源能源,保护生态环境.下列有关绿色消费的说法不正确的是( )
| A. | 提倡骑自行车或乘公交车上下班 | B. | 提倡使用一次性木筷 | ||
| C. | 推广使用无磷洗衣粉和无氟冰箱 | D. | 将煤液化或气化,获得清洁燃料 |
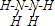 ;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:先产生蓝色沉淀,后沉消失,变成深蓝色的溶液;反应过程中的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-
;该元素还可与元素①形成10电子的气体分子Y,将过量的Y气体通入盛有含⑩元素的硫酸盐溶液中,反应过程中的实验现象为:先产生蓝色沉淀,后沉消失,变成深蓝色的溶液;反应过程中的离子方程式为Cu2++2NH3•H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3=[Cu(NH3)4]2++2OH-