题目内容
16.中学化学常见物质甲、乙、丙、丁之间存在转化关系:甲+乙→丙+丁.下列说法正确的是( )| A. | 若甲为铜,丁为氯化亚铁,则该反应为置换反应 | |
| B. | 若甲为碳,丁为硅,则丙一定是二氧化碳 | |
| C. | 若甲为铝,丁为三氧化二铝,则丙可能是镁 | |
| D. | 若甲为NH4+,乙为OH-,则甲、乙、丙、丁4种粒子均含10个电子 |
分析 根据甲+乙→丙+丁反应的关系,
A、若甲为铜单质,丁为氯化亚铁溶液,根据氧化还原反应原理和元素守恒,可知乙是氯化铁溶液,丙为氯化铜;
B、若甲为碳,丁为硅,则该反应为碳还原二氧化硅得硅和一氧化碳,所以乙为二氧化硅,丙是一氧化碳;
C、若甲为铝单质,丁为三氧化二铝,则该反应为铝热反应,乙也可以是铁的氧化物等;
D、若甲为NH4+,乙为OH-,甲与乙反应生成氨气和水,NH3、H2O、OH-、NH4+中都含10个电子,据此判断;
解答 解:根据甲+乙→丙+丁反应的关系,
A、若甲为铜单质,丁为氯化亚铁溶液,根据氧化还原反应原理和元素守恒,可知乙是氯化铁溶液,丙为氯化铜,生成物中没有单质,所以该反应不是置换反应,故A错误;
B、若甲为碳,丁为硅,则该反应为碳还原二氧化硅得硅和一氧化碳,所以乙为二氧化硅,则丙是一氧化碳,故B错误;
C、若甲为铝单质,丁为三氧化二铝,则该反应为铝热反应,乙也可以是铁的氧化物等,镁的金属性比铝强,所以丙不可能是镁,故C错误;
D、若甲为NH4+,乙为OH-,甲与乙反应生成氨气和水,NH3、H2O、OH-、NH4+中都含10个电子,故D正确,
故选D.
点评 本题是考查元素化合物知识,涉及基本反应类型的考查,难度不大,答题时注意熟记常见元素化合物之间的化学反应.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案
相关题目
6.如表实验操作、现象与结论对应关系正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向盛有Fe(NO3)2溶液的试管中加入0.1mol•L-1 H2SO4溶液 | 试管口出现红棕色气体 | 溶液中NO3-被Fe2+还原为NO2 |
| B | 向溶液中先滴加BaCl2溶液,再滴加稀盐酸 | 滴加BaCl2后出现白色沉淀,再滴加稀盐酸沉淀不溶解 | 溶液中一定含有SO42- |
| C | 在0.1mol•L-1 Na2CO3溶液中,加两滴酚酞显浅红色,微热 | 红色加深 | 盐类水解是吸热反应 |
| D | 向淀粉溶液中加入稀H2SO4,加热几分钟,冷却后再加入新制Cu(OH)2悬浊液,加热 | 无砖红色沉淀生成 | 淀粉没有水解生成葡萄糖 |
| A. | A | B. | B | C. | C | D. | D |
7.298 K时,N2与H2反应过程的能量变化如图所示.下列有关该反应的叙述不正确的是( )

| A. | 加人催化剂后,反应过程的能量变化可用曲线b表示 | |
| B. | 生成物的总能量小于反应物的总能量 | |
| C. | 热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92 kJ•mol-1 | |
| D. | 在298 K、恒容密闭容器中,通人1 mol N2和3 mol H,充分反应后放出的热量为92kJ |
4.下列说法正确的是( )
| A. | 分子晶体中一定存在分子间作用力,不一定有共价键 | |
| B. | 元素的非金属性越强,其单质的活泼性越强 | |
| C. | 含有金属阳离子的晶体不一定是离子晶体,离子晶体中一定含金属阳离子 | |
| D. | 溶于水后可电离出能自由移动离子的晶体一定是离子晶体 |
11.实验室可以用铁片与稀硫酸反应制取氢气,下列措施不能使氢气的生成速率增大的是( )
| A. | 加热 | |
| B. | 加入少量CuSO4溶液 | |
| C. | 不用稀硫酸,改用质量分数为98%的浓硫酸 | |
| D. | 不用铁片,改用铁粉 |
1.某同学研究金属与不同酸反应的差异,以及影响化学反应速率的元素.
实验药品:2.0mol•L-1盐酸、4.0mol•L-1盐酸、2.0mol•L-1硫酸、4.0mol•L-1硫酸,相同大小的铝片和铝粉(表面氧化膜都已除去).每次实验各种酸的用量均为50.0ml,金属用量均为9.0g.
(1)帮助该同学完成以下实验设计表.
(2)该同学在对比实验Ⅰ、Ⅱ、Ⅴ时发现实验Ⅰ和Ⅱ的反应速度都明显比实验Ⅴ快,你能对问题原因作出哪些假设或猜想(列出一种即可)?答:阴离子对该反应速率的影响.
实验药品:2.0mol•L-1盐酸、4.0mol•L-1盐酸、2.0mol•L-1硫酸、4.0mol•L-1硫酸,相同大小的铝片和铝粉(表面氧化膜都已除去).每次实验各种酸的用量均为50.0ml,金属用量均为9.0g.
(1)帮助该同学完成以下实验设计表.
| 实验目的 | 实验编号 | 温度 | 金属铝形态 | 酸及其浓度 |
| 1.实验Ⅰ和Ⅱ探究盐酸浓度对该反应速率的影响 2.实验Ⅱ和Ⅲ探究:③ 3.实验Ⅱ和Ⅳ探究金属规格(铝片、铝粉)对该反应速率的影响 4.Ⅰ、Ⅱ、Ⅲ实验探究铝与稀盐酸和稀硫酸反应的差异 | Ⅰ | 25℃ | 铝片 | 4.0moL/L盐酸 |
| Ⅱ | 25℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅲ | 35℃ | 铝片 | 2.0mol•L-1盐酸 | |
| Ⅳ | 25℃ | 铝片 | 2.0moL/L盐酸 | |
| Ⅴ | 25℃ | 铝片 | 2.0mol•L-1硫酸 |
8.某研究小组进行Mg(OH)2沉淀溶解和生成的实验探究.
向2支盛有1mL 1mol/L的MgCl2溶液中各加入10滴2mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如表:
(1)测得实验Ⅰ中所用NH4Cl溶液显酸性(pH约为4.5),用离子方程式解释其显酸性的原因NH4++H2O?NH3•H2O+H+.
(2)同学们猜测实验Ⅰ中沉淀溶解的原因有两种:
猜想1:氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水.
猜想2:氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水.
(3)为验证猜想,又设计了以下实验
①用醋酸铵溶液与氢氧化镁反应的原因是醋酸铵溶液呈中性,如果氢氧化镁能溶解于醋酸铵,说明是NH4+结合氢氧化镁电离出的OH-离子,导致沉淀溶解平衡移动正向移动,达到沉淀溶解.
②实验证明猜想正确的是1(填“1”或“2”).
(4)实验Ⅱ观察到沉淀不溶解.该实验的目的是做对比分析,排除实验中溶剂水使沉淀溶解的可能性.
向2支盛有1mL 1mol/L的MgCl2溶液中各加入10滴2mol/L NaOH,制得等量Mg(OH)2沉淀;然后分别向其中加入不同试剂,记录实验现象如表:
| 实验序号 | 加入试剂 | 实验现象 |
| Ⅰ | 4mL 2mol/L NH4Cl 溶液 | 沉淀溶解 |
| Ⅱ | 4mL蒸馏水 | 沉淀不溶解 |
(2)同学们猜测实验Ⅰ中沉淀溶解的原因有两种:
猜想1:氢氧化镁电离出OH-离子,与氯化铵电离出来的铵根离子反应生成氨水.
猜想2:氯化铵中NH4+离子水解出的H+,与氢氧化镁电离出OH-离子生成了水.
(3)为验证猜想,又设计了以下实验
| 序号 | 实验内容 | 结 果 |
| 1 | 测定醋酸铵溶液的pH | pH约为7,溶液呈中性 |
| 2 | 取少量的相同质量的氢氧化镁分别盛放在试管中,分别向其中滴加醋酸铵溶液和氯化铵溶液 | 固体均溶解 |
②实验证明猜想正确的是1(填“1”或“2”).
(4)实验Ⅱ观察到沉淀不溶解.该实验的目的是做对比分析,排除实验中溶剂水使沉淀溶解的可能性.
5.有关金属的腐蚀与防护叙述正确的是( )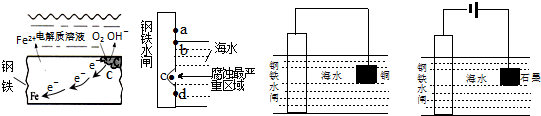

| A. | 钢铁发生吸氧腐蚀时,电子流动方向可用图甲示意图表示 | |
| B. | 钢铁水闸在发生吸氧腐蚀时,产生铁锈最多的位置在图乙d处 | |
| C. | 用牺牲阳极保护法保护钢铁水闸时,可用图丙所示装置示意 | |
| D. | 用外接电源阴极保护法保护钢铁水闸时,可用图丁所示装置示意 |
6.下列化学用语中表达正确的是( )
| A. | 四氯化碳的电子式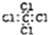 | B. | C2H4的球棍模型 | ||
| C. | 环已烷的结构简式 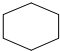 | D. | 次氯酸的结构式:H-Cl-O |