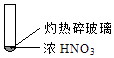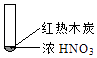题目内容
【题目】写出下列反应的化学方程式.
(1)电解饱和食盐水: .
(2)氢氧化钠溶液腐蚀磨砂玻璃塞: .
(3)实验室用亚硫酸钠与浓硫酸反应制备二化硫: .
(4)氢氧化铝溶于氢氧化钠溶液: .
(5)氨在催化剂的作用下与氧气发生反应,生成一氧化氮 .
【答案】
(1)2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(2)SiO2+2NaOH=Na2SiO3+H2O
(3)Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O
(4)Al(OH)3+NaOH=NaAlO2+2H2O
(5)4NH3+5O2![]() 4NO+6H2O
4NO+6H2O
【解析】解:(1)电解饱和食盐水阳极上氯离子失电子发生氧化反应得到氯气,电解反应2Cl﹣﹣2e﹣=Cl2↑,阴极上氢离子得到电子生成氢气,电解反应为2H++2e﹣=H2↑,总反应为:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑,
所以答案是:2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;(2)氢氧化钠溶液能与玻璃的主要成分二氧化硅反应生成硅酸钠和水,会使瓶口与玻璃塞粘在一起,故氢氧化钠溶液不能用带玻璃塞的细口瓶盛放,反应为:SiO2+2NaOH=Na2SiO3+H2O,
2NaOH+H2↑+Cl2↑;(2)氢氧化钠溶液能与玻璃的主要成分二氧化硅反应生成硅酸钠和水,会使瓶口与玻璃塞粘在一起,故氢氧化钠溶液不能用带玻璃塞的细口瓶盛放,反应为:SiO2+2NaOH=Na2SiO3+H2O,
所以答案是:SiO2+2NaOH=Na2SiO3+H2O;(3)亚硫酸钠与浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O,
所以答案是:Na2SO3+H2SO4(浓)═Na2SO4+SO2↑+H2O;(4)氢氧化铝为两性氢氧化物,能够与强碱溶液反应,氢氧化铝与氢氧化钠反应:Al(OH)3+NaOH=NaAlO2+2H2O,
所以答案是:Al(OH)3+NaOH=NaAlO2+2H2O;(5)NH3与过量O2在催化剂、加热条件下发生反应生成一氧化氮和水,反应的化学方程式方程为:4NH3+5O2 ![]() 4NO+6H2O,
4NO+6H2O,
所以答案是:4NH3+5O2 ![]() 4NO+6H2O.
4NO+6H2O.

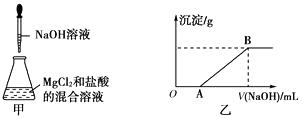
【题目】用50mL 0.50molL﹣1盐酸与50mL 0.55molL﹣1 NaOH溶液,在如图所示的装置中进行中和反应,通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 
起始温度t1/℃ | 终止温度t2/℃ | 温度差 | |||
HCl | NaOH | 平均值 | |||
1 | 25.5 | 25.0 | 25.25 | 28.5 | 3.25 |
2 | 24.5 | 24.2 | 24.45 | 27.6 | 3.15 |
3 | 25.0 | 24.5 | 24.75 | 26.5 | 1.75 |
(1)该实验中,量取50mL盐酸或NaOH溶液,需要用到的玻璃仪器除胶头滴管外还要;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指温度;
(4)计算该实验发生中和反应时放出的热量为J[中和后生成的溶液的比热容c=4.2J(g℃)﹣1 , 稀溶液的密度都为1gcm﹣3];
(5)若用50mL 0.55molL﹣1的氨水(NH3H2O)代替NaOH溶液进行上述实验,通过测得的反应热来计算中和热,测得的中和热△H会(填“偏大”、“偏大”或“不变”),其原因是 .
【题目】下述实验中均有红棕色气体产生,对比分析所的结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸产生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2 , 由此说明木炭一定与浓硝酸发生了反应