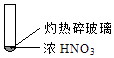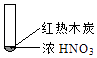题目内容
【题目】下述实验中均有红棕色气体产生,对比分析所的结论不正确的是( )
|
|
|
① | ② | ③ |
A.由①中的红棕色气体,推断产生的气体一定是混合气体
B.红棕色气体不能表明②中木炭与浓硝酸产生了反应
C.由③说明浓硝酸具有挥发性,生成的红棕色气体为还原产物
D.③的气体产物中检测出CO2 , 由此说明木炭一定与浓硝酸发生了反应
【答案】D
【解析】解:A.加热条件下,浓硝酸分解生成二氧化氮和氧气,则产生的气体一定是混合气体,故A正确;
B.在加热条件下,浓硝酸可分解生成二氧化氮,不一定与碳反应生成,故B正确;
C.硝酸中N元素化合价为+5价,生成二氧化氮的N元素化合价为+4价,化合价降低,在生成的红棕色气体为还原产物,故C正确;
D.碳加热至红热,可与空气中氧气反应生成二氧化碳,不一定为与浓硝酸发生了反应,故D错误.
故选D.
题中涉及实验都在加热条件下,浓硝酸不稳定,加热分解生成的二氧化氮气体为红棕色,且加热条件下,浓硝酸可与碳发生氧化还原反应,以此解答该题.

【题目】TiCl4是由钛精矿(主要成分为TiO2)制备钛(Ti)的重要中间产物,制备纯TiCl4的流程示意图如下:
资料:TiCl4及所含杂质氯化物的性质
化合物 | SiCl4 | TiCl4 | AlCl3 | FeCl3 | MgCl2 |
沸点/℃ | 58 | 136 | 181(升华) | 316 | 1412 |
熔点/℃ | ﹣69 | 25 | 193 | 304 | 714 |
在TiCl4中的溶解性 | 互溶 | ﹣ | 微溶 | 难溶 | |
(1)氯化过程:TiO2与Cl2难以直接反应,加碳生成CO和CO2可使反应得以进行.
已知:TiO2(s)+2Cl2(g)=TiCl4(g)+O2(g)△H1=+175.4kJmol﹣1
2C(s)+O2(g)=2CO(g)△H2=﹣220.9kJmol﹣1
①沸腾炉中加碳氯化生成TiCl4(g)和CO(g)的热化学方程式: .
②氯化过程中CO和CO2可以相互转化,根据如图判断:CO2生成CO反应的
△H0(填“>”“<”或“=”),判断依据: .
③氯化反应的尾气须处理后排放,尾气中的HCl和Cl2经吸收可得粗盐酸、FeCl3溶液,则尾气的吸收液依次是 .
④氯化产物冷却至室温,经过滤得到粗TiCl4混合液,则滤渣中含有 .
(2)精制过程:粗TiCl4经两步蒸馏得纯TiCl4 . 示意图如下:
物质a是 , T2应控制在 .