题目内容
【题目】向等物质的量浓度的HCl、AlCl3、NH4Cl、MgCl2混合溶液中逐滴加入1 mol·L-1的NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示。下列有关说法正确的是
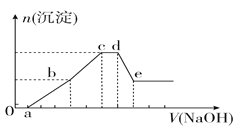
A.在0~a段加入的NaOH溶液与NH4Cl反应
B.在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3
C.c点溶液中溶质只有NaCl
D.在d~e段加入NaOH溶液发生反应的离子方程式为Al3++4OH-===AlO![]() +2H2O
+2H2O
【答案】B
【解析】
试题分析:A、氢氧化钠首先中和盐酸,然后沉淀金属阳离子,再与氯化铵反应,最后溶解氢氧化铝,在0~a段加入的NaOH溶液只与HCl反应,A错误;B、根据A中分析可知在滴加NaOH溶液全过程中主要粒子参与反应的先后顺序是H+、Al3+、Mg2+、NH4+、Al(OH)3,B正确;C、c点溶液中溶质有NaCl和NH4Cl,C错误;D、在d~e段加入NaOH溶液发生反应的离子方程式为Al(OH)3+OH-===AlO2-+2H2O,D错误,答案选B。

 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案【题目】通常人们把拆开1 mol某化学键所吸收的能量或形成1 mol某化学键所释放的能量看作该化学键的键能,键能的大小可用于估算化学反应的反应热(ΔH),已知
化学健 | H-H | Cl-Cl | H-Cl |
键能 | 436 kJ/mol | 243 kJ/mol | 431 kJ/mol |
则下列热化学方程式不正确的是( )
A.![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
Cl2(g)===HCl(g) ΔH=-91.5 kJ·mol-1
B.H2(g)+Cl2(g)===2HCl(g) ΔH=-183 kJ·mol-1
C.2HCl(g)===H2(g)+Cl2(g) ΔH=+183 kJ·mol-1
D.![]() H2(g)+
H2(g)+![]() Cl2(g)===HCl(g) ΔH=91.5 kJ·mol-1
Cl2(g)===HCl(g) ΔH=91.5 kJ·mol-1