题目内容
【题目】近年来燃煤脱硫技术受到各界科研人员的重视,某脱硫技术涉及如下反应:
Ⅰ. CaSO4(s)+CO(g)![]() CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ· mol-1
CaO(s)+SO2(g)+CO2(g) ΔH1=+218.4 kJ· mol-1
Ⅱ. CaO(s)+3CO(g)+SO2(g)![]() CaS(s)+3CO2(g) ΔH2=-394.0 kJ· mol-1
CaS(s)+3CO2(g) ΔH2=-394.0 kJ· mol-1
(1) 若用K1、K2分别表示反应Ⅰ、Ⅱ的化学平衡常数,则反应![]() CaSO4(s)+2CO(g)
CaSO4(s)+2CO(g)![]()
![]() CaS(s)+2CO2(g)的平衡常数K= (用含K1、K2的式子表示)。
CaS(s)+2CO2(g)的平衡常数K= (用含K1、K2的式子表示)。
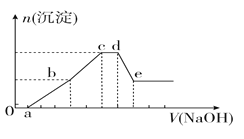
(2) 某科研小组研究在其他条件不变的情况下,改变起始一氧化碳物质的量对反应Ⅱ的影响,实验结果如右图所示(图中T表示温度)。

比较在a、b、c三点所处的平衡状态中,反应物SO2的转化率最高的是 。
②图像中T2 (填“高于”、“低于”、“等于”或“无法确定”)T1,判断的理由是 。
(3)反应3X+Y![]() 2Z在2 min达到平衡后的t1~t6内反应速率与反应时间图像如图,在每一时刻均改变一个影响反应速率的因素,则( )
2Z在2 min达到平衡后的t1~t6内反应速率与反应时间图像如图,在每一时刻均改变一个影响反应速率的因素,则( )

A.在t1时增大了压强 B.在t3时加入了催化剂
C.在t4时降低了温度 D.t2~t3时A的转化率最高
【答案】(1)![]() ; (2) ①c; ②高于,该反应为放热反应,升高温度平衡向逆反应方向移动,CO2体积分数降低,故T2高于T1 ;(3)B。
; (2) ①c; ②高于,该反应为放热反应,升高温度平衡向逆反应方向移动,CO2体积分数降低,故T2高于T1 ;(3)B。
【解析】
试题分析:(1)I:K1=c(SO2)×c(CO2)/c(CO),II:K2=c3(CO2)/[c3(CO)×c(SO2)],K=c2(CO2)/c2(CO),因此得出K=![]() ;(2)①CO增多,SO2的转化率增大,因此c点SO2的转化率最高;②高于,该反应为放热反应,升高温度平衡向逆反应方向移动,CO2体积分数降低,故T2高于T1 ;(3)A、t1时刻,逆反应增大,正反应不变,说明增大的是生成物的浓度,改变压强,正逆反应速率都增大,故错误;B、t3时刻反应速率增大,但平衡不移动,说明使用了催化剂,故正确;C、此反应不知道是放热反应还是吸热反应,无法判断,故错误;D、t1到t4都是向逆反应方向进行,转化率降低,因此转化率最高在t0,故错误。
;(2)①CO增多,SO2的转化率增大,因此c点SO2的转化率最高;②高于,该反应为放热反应,升高温度平衡向逆反应方向移动,CO2体积分数降低,故T2高于T1 ;(3)A、t1时刻,逆反应增大,正反应不变,说明增大的是生成物的浓度,改变压强,正逆反应速率都增大,故错误;B、t3时刻反应速率增大,但平衡不移动,说明使用了催化剂,故正确;C、此反应不知道是放热反应还是吸热反应,无法判断,故错误;D、t1到t4都是向逆反应方向进行,转化率降低,因此转化率最高在t0,故错误。

【题目】根据键能数据估算CH4(g)+4F2(g)=CF4(g)+4HF(g)的反应热△H为( )
化学键 | C-H | C-F | H-F | F-F |
键能/(kJ/mol) | 414 | 489 | 565 | 155 |
A.+485kJ/mol B.-485kJ/mol C.+1940kJ/mol D.-1940kJ/mol
【题目】
①该学生需要量取 mL上述浓盐酸进行配制。
②配制过程中正确的操作顺序是(字母表示) 。
A.用少量水洗涤烧杯2~3次,洗涤液均注入容量瓶,振荡 |
B.用量筒准确量取所需浓盐酸,沿玻璃棒倒入烧杯中,再加入少量水,用玻璃棒慢慢搅动,使其混合均匀 |
C.将已冷却的盐酸沿玻璃棒注入500mL容量瓶中 |
D.将容量瓶盖紧、振荡、摇匀 |
E.改用胶头滴管加水,使溶液凹面恰好与刻度相切
F.继续往容量瓶内小心加水,直至液面接近刻度1~2cm处
③下列实验操作中所配制的稀盐酸的物质的量浓度偏大的有( )
a.用量筒量取浓盐酸,俯视观察,凹液面
b.定容后经振荡、摇匀、静置,发现液面下降,再加适量蒸馏水
c.稀释浓盐酸,未冷却到室温即转移到容量瓶中
d.容量瓶洗涤干净后未干燥
e.将量取浓盐酸的量筒进行洗涤,并将洗涤转移到容量瓶中
④若在标准状况下,将VL HCl气体溶解在1L水中(水的密度近似为1g/mL),所得溶液密度为![]() g/mL,则此溶液中HCl的物质的量浓度为 mol·L—1。
g/mL,则此溶液中HCl的物质的量浓度为 mol·L—1。