题目内容
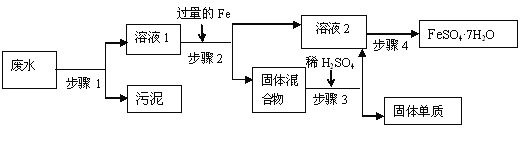
【题目】羰基硫(COS)广泛存在于煤、石油和天然气为原料的化工生产中,不经处理直接排放会引起大气污染,石油化工中产生的羰基硫可通过以下方法脱除。
Ⅰ.干法脱除:在催化剂存在下,COS和H2可发生两个平行反应:
i. COS(g)+H2(g)![]() H2S(g)+CO(g)△H1=-17kJ/mol
H2S(g)+CO(g)△H1=-17kJ/mol
ii. COS(g)+4H2(g)![]() H2S(g)+CH4(g)+H2O(g) △H2
H2S(g)+CH4(g)+H2O(g) △H2
(1)已知:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206kJ/mol,则△H2=______________。
CO(g)+3H2(g)△H=+206kJ/mol,则△H2=______________。
(2)T1℃时,向10L恒容密闭容器中充人1molCOS和4molH2,发生反应i和ii。5min时达到平衡,测得体系压强减少了20%,CO的体积分数为10%且其平衡分压为P1。
①0-5min内,v(COS)=______________。
②反应i的平衡常数K=______________。
③若在起始温度为T1℃的绝热容器中重复上述实验,H2的平衡分压P2______________P1(填“>”“=”或“<”),理由为______________。
Ⅱ.湿法脱除:原理为COS+4OH-=S2-+CO32-+2H2O。温度为293K时,将COS以固定流速匀速通入一定浓度的NaOH溶液中,测得体系内c(S2-)随时间(t)的变化如图所示:
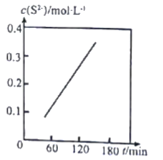
(3)由图可知,增大NaOH溶液的初始浓度,COS的吸收速率______________(填“增大”“减小”或“不变”),判断依据为______________。
(4)在上述反应体系中同时加入少量溴水,也能吸收COS并得到澄清溶液,发生反应的化学方程式为______________。
【答案】-223kJ/mol 0.018mol·L-1·min-1 2.25 > 反应i和ii均为放热反应,温度升高,平衡逆移,氢气的转化率降低,平衡分压增大;升高温度,气体总压强增大 不变 随着反应的进行,c(OH-)不断减小,但曲线的斜率(代表反应速率)不变 COS+4Br2+12NaOH=Na2CO3+Na2SO4+8NaBr+6H2O
【解析】
(2)设平衡时体系内n(CO)=x mol,初始投料为1molCOS和4molH2,根据反应方程式COS(g)+H2(g)![]() H2S(g)+CO(g)可知,此反应消耗的ni(COS)= ni(H2)=x mol,生成的ni(H2S)=x mol;
H2S(g)+CO(g)可知,此反应消耗的ni(COS)= ni(H2)=x mol,生成的ni(H2S)=x mol;
设平衡时体系内n(COS)=y mol,则反应ii消耗的nii(COS)=(1-x-y)mol,根据方程式COS(g)+4H2(g)![]() H2S(g)+CH4(g)+H2O(g)可知,此反应消耗的nii(H2)=4(1-x-y)mol,生成的nii(H2S)= nii(CH4)= nii(H2O)=(1-x-y)mol;
H2S(g)+CH4(g)+H2O(g)可知,此反应消耗的nii(H2)=4(1-x-y)mol,生成的nii(H2S)= nii(CH4)= nii(H2O)=(1-x-y)mol;
所以此时容器中n(COS)=y mol,n(H2)=4mol-xmol-4(1-x-y)mol=(3x+4y)mol,n(CO)=x mol,n(H2S)=x mol+(1-x-y)mol=(1-y)mol,nii(CH4)= nii(H2O)=(1-x-y)mol;
达到平衡时测得体系压强减少了20%,恒容密闭容器压强之比等于气体的物质的量之比,所以![]() ,CO的体积分数为10%,所以
,CO的体积分数为10%,所以![]() ,解得x=0.4mol,y=0.1mol;
,解得x=0.4mol,y=0.1mol;
所以平衡时n(COS)=0.1mol,n(H2)=1.6mol,n(CO)=0.4mol,n(H2S)=0.9mol,n(CH4)= n(H2O)=0.5mol。
Ⅰ. (1)已知i COS(g)+H2(g)![]() H2S(g)+CO(g)△H1=-17kJ/mol;
H2S(g)+CO(g)△H1=-17kJ/mol;
iii:CH4(g)+H2O(g)![]() CO(g)+3H2(g)△H=+206kJ/mol;
CO(g)+3H2(g)△H=+206kJ/mol;
根据盖斯定律由i-iii可得反应COS(g)+4H2(g)![]() H2S(g)+CH4(g)+H2O(g)△H2=-17 kJ/mol-206kJ/mol=-223kJ/mol;
H2S(g)+CH4(g)+H2O(g)△H2=-17 kJ/mol-206kJ/mol=-223kJ/mol;
(2) ①根据分析可知平衡时n(COS)=0.1 mol,所以△n(COS)=0.9mol,容器体积为10L,所以v(COS)=![]() = 0.018mol·L-1·min-1;
= 0.018mol·L-1·min-1;
②根据分析可知平衡时n(COS)=0.1mol,n(H2)=1.6mol,n(CO)=0.4mol,n(H2S)=0.9mol,反应i前后气体系数之和相等,所以可以用物质的量来代替浓度计算平衡常数,K=![]() =2.25;
=2.25;
③反应i和ii均为放热反应,反应过程中温度升高,平衡逆移,氢气的转化率降低,平衡分压增大;升高温度,气体总压强增大,所以P2>P1;
Ⅱ.(3)随着反应的进行,c(OH-)不断减小,但曲线的斜率(代表反应速率)不变,说明增大NaOH溶液的初始浓度,COS的吸收速率不变;
(4)溴水具有氧化性,可以将COS中S元素氧化成硫酸根,根据电子守恒和元素守恒可得方程式为COS+4Br2+12NaOH=Na2CO3+Na2SO4+8NaBr+6H2O

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某化学实验小组用酸性KMnO4溶液和草酸(H2C2O4)溶液反应,研究外界条件反应速率的影响,实验操作及现象如下:
编号 | 实验操作 | 实验现象 |
I | 向一支试管中先加入1mL 0.01 mol/L酸性 KMnO4溶液,再加入1滴3mol/L硫酸和9滴蒸馏水,最后加入1mL 0.1mol/L草酸溶液 | 前10min内溶液紫色无明显变化,后颜色逐渐变浅, 30 in后几乎变为无色 |
II | 向另一支试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,再加入10滴3mol/L硫酸,最后加入1mL 0.1mol/L草酸溶液 | 80s内溶液紫色无明显变化,后颜色迅速变浅,约150s后几乎变为无色 |
(1)高锰酸钾与草酸反应的离子方程式:______________________________________
(2)由实验I、II可得出的结论是____________________________。
(3)关于实验II中80s后溶液颜色迅速变浅的原因,该小组提出了猜想:该反应中生成的Mn2+对反应有催化作用。利用提供的试剂设计实验III,验证猜想。
提供的试剂:0.01mol/L酸性 KMnO4溶液,0.1mol/L草酸溶液,3mol/L硫酸,MnSO4溶液,MnSO4固体,蒸馏水
① 补全实验III的操作:向试管中先加入1mL 0.01mol/L酸性 KMnO4溶液,______,最后加入1mL 0.1mol/L草酸溶液。
② 若猜想成立,应观察到的实验现象是______。
(4)该小组拟采用如图所示的实验方案继续探究外界条件对反应速率的影响。
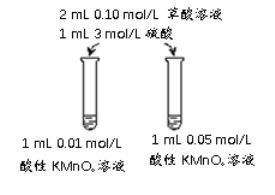
① 他们拟研究的影响因素是______。
② 你认为他们的实验方案______(填“合理”或“不合理”),理由是______。