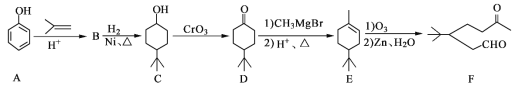
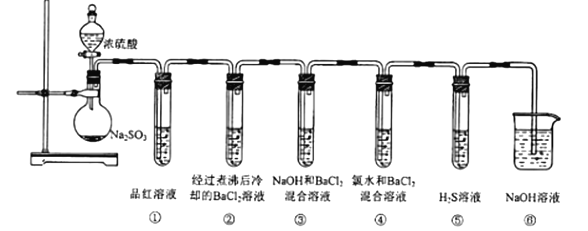
题目内容
【题目】A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大。第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,B原子的最外层p轨道的电子为半充满结构,C是地壳中含量最多的元素。D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满。请回答下列问题:
(1)A、B、C的第一电离能由小到大的顺序是_______(用对应的元素符号表示);基态D原子的电子排布式为______。
(2)A的最高价氧化物对应的水化物分子中,其中心原子采取_____杂化;BC3-的立体构型为______(用文字描述)。
(3)1mol AB-中含有的π键个数为______。
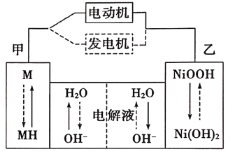
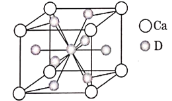
(4)如图是金属Ca和D所形成的某种合金的晶胞结构示意图,则该合金中Ca和D的原子个数比______。
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,它们有很强的储氢能力。己知镧镍合金LaNin晶胞体积为9.0×10-23cm3,储氢后形成LaNinH4.5合金(氢进入晶胞空隙,体积不变),则LaNin中n=________(填数值);氢在合金中的密度为________(保留2位有效数字)。
【答案】C<O<N 1s22s22p63s23p63d104s1或[Ar]3d104s1 sp2 平面三角形 2NA(或2×6.02×1023) 1∶5 5 0.083 g·cm-3
【解析】
A、B、C、D是元素周期表中前36号元素,它们的核电荷数依次增大;第二周期元素A原子的核外成对电子数是未成对电子数的2倍且有3个能级,则A是C元素;C是地壳中含量最多的元素,则C是O元素;B原子的最外层p轨道的电子为半充满结构,且原子序数大于A而小于C,则B是N元素;D是第四周期元素,其原子核外最外层电子数与氢原子相同,其余各层电子均充满,则D是Cu元素;
(1)同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素;
基态D原子核外有29个电子,根据构造原理书写基态D原子的简化电子排布式;
(2)A的最高价氧化物对应的水化物是H2CO3,该分子中中心原子C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断其中心原子杂化方式及碳酸根离子空间构型;
(3)CN-与N2互为等电子体,则每个CN-中含有C、N三键,1个σ键,2个π键,据此计算1mol CN-中含有的π键个数;
(4)根据图示的金属Ca和Cu所形成的某种合金的晶胞结构,利用均摊法计算Ca、Cu原子个数之比;
(5)镧镍合金与上述合金都具有相同类型的晶胞结构XYn,根据Ca、Cu合金确定该镧镍合金中n值;其密度根据ρ=![]() 计算。
计算。
根据上述分析可知:A是C元素;B是N元素;C是O元素;D是Cu元素。
(1)同一周期元素,元素第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,所以C、N、O元素第一电离能从小到大顺序是C<O<N;
基态Cu原子核外有29个电子,根据构造原理,基态Cu原子的核外电子排布式是1s22s22p63s23p63d104s1,简化电子排布式为[Ar]3d104s1;
(2)A是C元素,C元素的最高价氧化物对应的水化物是H2CO3,分子中的中心C原子价层电子对个数是3且不含孤电子对,根据价层电子对互斥理论判断其中心原子杂化方式为sp2杂化,CO32-空间构型为平面三角形;
(3)CN-与N2互为等电子体,则每个CN-中C、N原子之间形成三个共价键,其中含有1个σ键,含有2个π键,则1mol CN-中含有的π键个数为2NA;
(4)根据金属Ca和Cu所形成的某种合金的晶胞结构示意图可知:该晶胞中Ca原子个数=8×![]() =1,含有的Cu原子个数=8×
=1,含有的Cu原子个数=8×![]() +1=5,则该晶体中Ca、Cu原子个数之比为1:5;
+1=5,则该晶体中Ca、Cu原子个数之比为1:5;
(5)Ca、Cu合金化学式为CaCu5,镧镍合金与上述合金都具有相同类型的晶胞结构XYn,所以该镧镍合金中n=5;
该物质密度ρ= g/cm3=0.083g/cm3。
g/cm3=0.083g/cm3。

 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案