题目内容
【题目】溶液中存在电离平衡、水解平衡、沉淀溶解平衡等多种形式的化学平衡。
(1)常温下,用0.10molL-1NaOH溶液滴定20.00mL0.10molL-1CH3COOH溶液,滴定曲线如图所示。
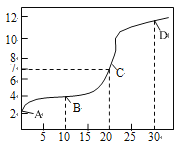
①B点所示的溶液中:c(Na+)+c(H+)_____c(CH3COOH)+c(OH-)(填“>”、“=”或“<“)。
②C点为理论上的反应终点,则该滴定实验应选用的指示剂是____,此时溶液的pH大于7,原因是____(用化学用语表示)。
③点D所示溶液中c(H+)、c(OH-)、c(CH3COOH)、c(CH3COO-)四者之间的等量关系式为:c(OH-)-c(H+)=______。
(2)已知常温时Ksp[Al(OH)3]=1×10-33,Ksp[Mg(OH)2]=5.6×10-12,Ksp(CaCO3)=2.80×10-9,Ksp(CaSO4)=4.9×10-5。
①常温下,某溶液中c(Mg2+)=5.6mol/L,欲除去该溶液中的Al3+(使其浓度小于1×10-5mol/L),需要调节pH的范围为______<pH<_____。
②常温下,CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq)平衡常数的值为_______。
CaCO3(s)+SO42-(aq)平衡常数的值为_______。
【答案】> 无色酚酞试液 CH3COO-+H2O![]() CH3COOH+OH- 1.5c(CH3COOH)+0.5c(CH3COO-) 4.7 8 1.75×104
CH3COOH+OH- 1.5c(CH3COOH)+0.5c(CH3COO-) 4.7 8 1.75×104
【解析】
(1)①B点溶液中溶质为CH3COOH和CH3COONa,且n(CH3COOH):n(CH3COONa)=1:1,此时溶液显酸性,说明CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COOH) <c(CH3COO-),由溶液中的电荷守恒式可知c(Na+)+c(H+)= c(CH3COO-)+c(OH-)>c(CH3COOH)+c(OH-);
②C点恰好完全反应生成CH3COONa,CH3COO-水解使溶液显碱性,则用NaOH溶液滴定CH3COOH溶液时应选择无色酚酞试液作指示剂;滴定终点时溶液的pH大于7,原因是CH3COO-水解,发生的水解反应式为CH3COO-+H2O![]() CH3COOH+OH-;
CH3COOH+OH-;
③D点溶液中溶质为NaOH和CH3COONa,且n(NaOH):n(CH3COONa)=1:2,此时溶液中的电荷守恒式为c(Na+)+c(H+)= c(CH3COO-)+c(OH-),物料守恒式为c(Na+)= 1.5c(CH3COOH) +1.5c(CH3COO-),则c(OH-)-c(H+)= c(Na+)- c(CH3COO-)=1.5c(CH3COOH) +1.5c(CH3COO-)- c(CH3COO-)=1.5c(CH3COOH)+0.5c(CH3COO-);
(2)①已知Ksp[Al(OH)3]=1×10-33,则Al3+沉淀完全时c(OH-)=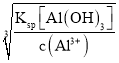 =
=![]() mol/L=
mol/L=![]() mol/L,此时溶液的pH≈4.7,Ksp[Mg(OH)2]=5.6×10-12,则Mg2+开始沉淀时c(OH-)=
mol/L,此时溶液的pH≈4.7,Ksp[Mg(OH)2]=5.6×10-12,则Mg2+开始沉淀时c(OH-)=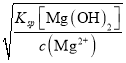 =
=![]() mol/L=10-6mol/L,此时溶液的pH=8,则除去该溶液中的Al3+,需要调节pH的范围为4.7<pH<8;
mol/L=10-6mol/L,此时溶液的pH=8,则除去该溶液中的Al3+,需要调节pH的范围为4.7<pH<8;
②溶浸过程会发生:CaSO4(s)+CO32-(aq)![]() CaCO3(s)+SO42-(aq),依据硫酸钙、碳酸钙溶度积常数的计算表达式,反应的平衡常数K=
CaCO3(s)+SO42-(aq),依据硫酸钙、碳酸钙溶度积常数的计算表达式,反应的平衡常数K=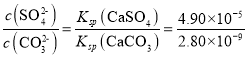 =1.75×104。
=1.75×104。