题目内容
利用右图所示装置进行下列实验,能得出相应实验结论的是( )
| 选项 | ① | ② | ③ | 实验结论 |  |
| A | 稀硫酸 | Na2S | AgNO3与AgCl的浊液 | Ksp(AgCl)>Ksp(Ag2S) | |
| B | 浓硫酸 | 蔗糖 | 溴水 | 浓硫酸具有脱水性、氧化性 | |
| C | 稀盐酸 | Na2SO3 | Ba(NO3)2溶液 | SO2与可溶性钡盐均可以生成白色沉淀 | |
| D | 浓硝酸 | Na2CO3 | Na2SiO3溶液 | 酸性:硝酸>碳酸>硅酸 |
B
解析试题分析:A、①②发生反应,产生的H2S在试管中与③中的遇AgNO3与AgCl的溶液,与Ag+结合生成Ag2S沉淀,这与Ksp(AgCl)和Ksp(Ag2S)的大小无关,错误;B、浓硫酸有脱水性,能够使蔗糖脱水碳化。然后浓硫酸与C单质的反应,生成CO2和SO2,在试管中与溴水反应氧化还原反应得到硫酸和氢溴酸。因此证明了浓硫酸具有脱水性、氧化性,正确;C、SO2溶解在试管中使溶液显酸性,这时就与Ba(NO3)2溶液发生氧化还原反应得到SO42-,再发生离子反应得到硫酸钡白色沉淀。若在③中无氧化性的物质存在,则不能发生沉淀反应。错误;D、浓硝酸有挥发性,挥发出的硝酸也会与Na2SiO3溶液反应得到硅酸沉淀。因此不能证明酸性:硝酸>碳酸>硅酸。错误。
考点:考查物质的性质与相互转化关系的知识。

下列事实中,能说明MOH是弱碱的有
①0.1mol/LMOH可以使酚酞试液变红
②0.1mol/LMCl溶液的呈酸性
③0.1mol/LMOH溶液的导电性比0.1mol/LNaOH溶液弱
④等体积的0.1mol/LMOH溶液与0.1mol/LHCl溶液恰好完全反应
| A.①②③ | B.②③ | C.②④ | D.③④ |
由一价离子组成的四种盐AC、BD、AD、BC均为0.1 mol/L溶液,在同温下,前两种溶液pH=7,第三种溶液pH>7,最后一种溶液pH<7, 则形成四种盐的酸和碱强弱比较正确的是
| | A | B | C | D |
| 碱 性 | AOH>BOH | AOH>BOH | AOH<BOH | AOH<BOH |
| 酸 性 | HC<HD | HC>HD | HC>HD | HC< HD |
下列溶液中各离子的浓度关系不正确的是( )
| A.0.1 mol·L-1CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)=0.1 mol·L-1 |
| B.浓度均为0.1 mol·L-1 Na2CO3溶液和稀盐酸等体积混合后的溶液中: c(CO 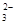 )+c(OH-)=c(H+)+c(H2CO3) )+c(OH-)=c(H+)+c(H2CO3) |
| C.25 ℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中: c(Na+>c(CN-)>c(HCN)>c(OH-) |
| D. 3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中: |
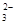 )>c(HCO
)>c(HCO )>c(OH-)>c(H+)
)>c(OH-)>c(H+) 下列溶液中粒子的物质的量浓度关系正确的是
| A.0.1mol/LNaHCO3溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中: c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| B.20ml0.1mol/LCH3COONa溶液与10ml0.1mol/LHCl溶液混合后呈酸性,所得溶液中: c(CH3COO-)>c(Cl-)>c(CH3COOH)>c(H+) |
| C.室温下,pH=2的盐酸与pH=12的氨水等体积混合,所得溶液中: c(Cl-)>c(H+)>c(NH4+)>c(OH-) |
| D.0.1mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合,所得溶液中: |
已知某温度下CH3COOH和NH3?H2O 的电离常数相等,现向10mL浓度为0.1mol?L?1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中
| A.水的电离程度始终增大 |
| B.c(NH4+)/c(NH3?H2O)先增大再减小 |
| C.c(CH3COOH)与c(CH3COO?)之和始终保持不变 |
| D.当加入氨水的体积为10mL时,c(NH4+)=c(CH3COO?) |
由几种常见的盐混合组成的白色粉末,其中只可能含有Na+、K+、Al3+、CO32-、HCO3-、SO42-、NO2-中的若干种离子。某同学对该溶液进行如下实验: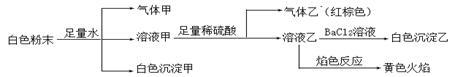
以下说法正确的是
| A.白色沉淀甲是Al(OH)3,气体甲是CO2,所以混合物一定含Al3+和HCO3- |
| B.气体乙一定是NO和NO2的混合气体 |
| C.白色沉淀乙是BaSO4,所以原混合物一定含有SO42- |
| D.白色粉末中一定含有Na+ 、Al3+ 、NO2- |
25℃时,下列各溶液(均为0.1 mol·L-1)中,离子(或分子)的物质的量浓度关系正确的是
| A.氯化铵溶液中:c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
| B.碳酸钠溶液中:c(HCO3-)+c(CO32-)+c(H2CO3)=0.1 mol·L-1 |
| C.醋酸钠溶液中:c(OH-)>c(H+)+c(CH3COOH) |
| D.碳酸氢钠溶液中:c(Na+)-c(OH-)=c(HCO3-)+c(CO32-)-c(H+) |
常温下,向20.00 mL 0.100 mol·L-1CH3COONa溶液中逐滴加入0.100 mol·L-1盐酸,溶液的pH与所加入盐酸体积的关系如图所示(不考虑挥发)。下列说法正确的是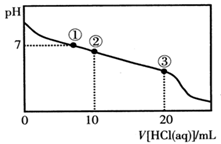
| A.点①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-) |
| B.点②所示溶液中:c(Na+)>c(Cl-)>c(CH3COO-)>c(CH3COOH) |
| C.点③所示溶液中:c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO-) |
| D.整个过程中可能出现:c(H+)+c(Na+)=c(CH3COO-)+c(CH3COOH) |