题目内容
11.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成的晶体结构如图所示.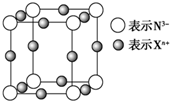
①该晶体的阳离子与阴离子个数比为3:1.
②该晶体中Xn+离子中n=1.
③X元素的原子序数是29.
④晶体中每个N3-被6个等距离的Xn+离子包围.
分析 ①根据均摊法计算晶胞中Xn+、N3-离子数目进行解答;
②结合①中计算,在利用化合价代数和为0计算;
③Xn+中所有电子正好充满K、L、M三个电子层,Xn+所含电子=2+8+18=28,故原子序数为28+n;
④以顶角上的N3-为中心,晶胞中与之距离最近的Xn+有3个,而每个顶点为8个晶胞共用,棱上原子为4个晶胞所共用,所以每个原子为1个晶胞提供$\frac{1}{4}$.
解答 解:①晶胞中Xn+可知数目为12×$\frac{1}{4}$=3、N3-离子数目为8×$\frac{1}{8}$=1,故该晶体的阳离子与阴离子个数比为3:1,故答案为:3:1;
②由化合价代数和为0,可知3n-3=0,故n=1,故答案为:1;
③Xn+中所有电子正好充满K、L、M三个电子层,Xn+所含电子=2+8+18=28,故原子序数为28+1=29,故答案为:29;
④以顶角上的N3-为中心,晶胞中与之距离最近的Xn+有3个,而每个顶点为8个晶胞共用,棱上原子为4个晶胞所共用,所以每个原子为1个晶胞提供$\frac{1}{4}$,故则每个N3-周围与之距离最近的X+数目为:8×3×$\frac{1}{4}$=6,故答案为:6.
点评 本题考查晶胞结构及计算,注意利用均摊法进行晶胞有关计算,需要学生具有一定空间想象能力,难度中等.

练习册系列答案
相关题目
1.在常温下,把一个盛有等物质的量的甲烷和氯气的密闭玻璃容器放在光亮的地方,两种气体充分反应,下列叙述中不正确的是( )
| A. | 容器内原子总数不变 | |
| B. | 足够长时间后容器内氯化氢分子数最少 | |
| C. | 容器内气体颜色变浅 | |
| D. | 容器内分子总数不变 |
2.25℃时,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 0.1 mol•L-1NaAlO2溶液:Al3+、Na+、Cl-、NO3- | |
| B. | 加入金属铝产生H2的溶液中:NH4+、K+、SO42-、NO3- | |
| C. | 含有大量ClO-的溶液中:K+、Na+、NO3-、SO42- | |
| D. | 室温下,pH=1的溶液中:Na+、Fe3+、NO3-、SO32- |
19.下列对相应有机物的描述完全正确的是( )
①甲烷:天然气的主要成分,能发生取代反应
②乙烯:一个国家石油化工发展水平的标志,可以发生加成反应
③苯:平面结构,每个分子中含有3个碳碳双键
④油脂:属于高分子化合物,可以发生水解反应
⑤淀粉:属于糖类物质,遇碘元素变蓝色
⑥蛋白质:遇浓硝酸显黄色,水解的最终产物为氨基酸.
①甲烷:天然气的主要成分,能发生取代反应
②乙烯:一个国家石油化工发展水平的标志,可以发生加成反应
③苯:平面结构,每个分子中含有3个碳碳双键
④油脂:属于高分子化合物,可以发生水解反应
⑤淀粉:属于糖类物质,遇碘元素变蓝色
⑥蛋白质:遇浓硝酸显黄色,水解的最终产物为氨基酸.
| A. | ①②③ | B. | ②④⑥ | C. | ①⑤⑥ | D. | ①②⑥ |
6.今有高聚物  对此分析正确的是( )
对此分析正确的是( )
 对此分析正确的是( )
对此分析正确的是( )| A. | 它是一种体型高分子化合物 | B. | 其单体是CH2=CH2和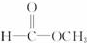 | ||
| C. | 其链节是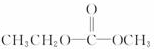 | D. | 其单体是 |
16.如图是常见四种有机物的比例模型示意图.下列说法正确的是( )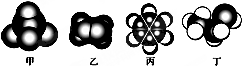

| A. | 甲的二氯代物只有一种 | |
| B. | 乙能与溴水发生取代反应而使溴水褪色 | |
| C. | 1mol丙中含有碳碳双键的数目是3NA | |
| D. | 丁在稀硫酸作用下可与甲酸发生取代反应 |
3.戊烷(C5H12) 共有a种同分异构体,甲苯( )共有b种一氯代物,则a、b的数值分别为( )
)共有b种一氯代物,则a、b的数值分别为( )
 )共有b种一氯代物,则a、b的数值分别为( )
)共有b种一氯代物,则a、b的数值分别为( )| A. | 2、3 | B. | 3、4 | C. | 4、4 | D. | 3、5 |
20.下列各组离子在指定溶液中能够大量共存的是( )
| A. | 无色溶液:K+、Al3+、NO3-、HCO3- | |
| B. | 常温下c(H+)/c(OH-)=1×10-12的溶液:Na+、K+、AlO2-、CO32- | |
| C. | 强酸性溶液:NH4+、Na+、SO32-、NO3- | |
| D. | 加入苯酚显紫色的溶液:K+、NH4+、Cl-、I- |